Différence entre l'oxydation et la réduction
Le différence clé entre l'oxydation et la réduction est que L'oxydation se réfère à la perte d'électrons tandis que la réduction se réfère au gain d'électrons.
Les réactions chimiques entre différents composés sont appelées réactions redox si les états d'oxydation des réactifs sont différents de ceux des produits. Redox est court pour la réduction-oxydation, ce qui se produit dans toute réaction chimique. Tandis que les oxydations se réfèrent à la perte d'électrons, les réductions sont l'endroit où se trouvent les électrons. Ces réactions peuvent être simples ou complexes, selon le processus et les atomes impliqués.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'oxydation
3. Qu'est-ce que la réduction
4. Comparaison côte à côte - oxydation vs réduction de la forme tabulaire
5. Résumé
Qu'est-ce que l'oxydation?
L'oxydation peut être décrite comme une augmentation du nombre d'oxydation. Par conséquent, l'oxydation peut être définie comme la perte d'électrons d'un atome, une molécule ou un ion. Cette perte d'électrons fait augmenter l'état d'oxydation des espèces chimiques. Puisqu'une réaction d'oxydation libère des électrons, il devrait y avoir une espèce d'acceptation d'électrons. Par conséquent, la réaction d'oxydation est une demi-réaction d'une réaction majeure. L'oxydation d'une espèce chimique est donnée comme le changement de ses états d'oxydation. L'état d'oxydation est un nombre avec un symbole positif (+) ou négatif (-), qui indique la perte ou le gain d'électrons par un atome, une molécule ou un ion particulier.

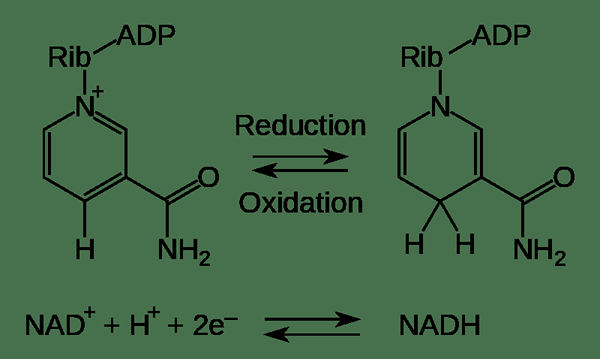
Figure 01: Un exemple des deux demi-réactions: oxydation et réduction
Dans le passé, le terme oxydation a été donné la définition «l'ajout d'oxygène à un composé."C'est parce que l'oxygène était le seul agent oxydant connu à l'époque. Cependant, cette définition n'est plus exacte car il y a beaucoup plus de réactions d'oxydation qui se produisent en l'absence d'oxygène. Par exemple, la réaction entre le magnésium (Mg) et l'acide chlorhydrique (HCl) n'implique pas d'oxygène, mais c'est une réaction redox qui inclut l'oxydation de Mg en Mg2+.
Qu'est-ce que la réduction?
La réduction peut être décrite comme une diminution du nombre d'oxydation. Par conséquent, nous pouvons définir la réduction comme le gain d'électrons à partir d'un atome, d'une molécule ou d'un ion. Ce gain d'électrons entraîne une diminution de l'état d'oxydation des espèces chimiques. Puisqu'une réaction de réduction obtient des électrons, il devrait y avoir une espèce donnant des électrons. Par conséquent, la réaction de réduction est une demi-réaction d'une réaction majeure. La réduction d'une espèce chimique est donnée comme le changement de ses états d'oxydation.
Dans le passé, le terme réduction a reçu la définition «l'élimination de l'oxygène d'un composé."C'est parce que l'oxygène était le seul agent oxydant connu à l'époque. Cependant, cette définition n'est plus exacte car il y a beaucoup plus de réactions d'oxydation qui se produisent en l'absence d'oxygène.
Quelle est la différence entre l'oxydation et la réduction?
La réduction et l'oxydation sont des processus chimiques impliqués dans chaque réaction chimique. Ce sont deux réactions opposées. La principale différence entre l'oxydation et la réduction est que l'oxydation fait référence à la perte d'électrons tandis que la réduction fait référence au gain d'électrons. Alors que l'oxydation augmente la valeur du signe positif (+), la réduction augmente la valeur du signe négatif (-).
Résumé - Oxydation vs réduction
La réduction et l'oxydation sont des processus chimiques impliqués dans chaque réaction chimique. La principale différence entre l'oxydation et la réduction est que l'oxydation fait référence à la perte d'électrons tandis que la réduction fait référence au gain d'électrons.
Référence:
1. Helmenstine, Anne Marie. «Définition et exemple d'oxydation en chimie."Thoughtco, février. 12, 2020, disponible ici.
2. Helmenstine, Anne Marie. «Définition de réduction de la chimie."Thoughtco, février. 11, 2020, disponible ici.
Image gracieuseté:
1. «Réduction de l'oxydation du NAD» par FvasConcellos 19:44, 9 décembre 2007 (UTC). W: Image: réduction de l'oxydation NAD.PNG par Tim Vickers. - Version vectorielle de W: Image: NAD Oxydation Réduction.PNG par Tim Vickers (domaine public) via Commons Wikimedia


