Différence entre le monoxyde d'azote et le pentoxyde de dinitrogen
Le différence clé entre le monoxyde d'azote et le pentoxyde de dinitrogen Le monoxyde d'azote est un gaz incolore tandis que le pentoxyde de dinitrogen est un solide blanc.
Le monoxyde d'azote et le pentoxyde de dinitrogen sont des composés chimiques contenant de l'azote et de l'oxygène. Ce sont des oxydes d'azote. Cependant, ils ont des propriétés chimiques et physiques différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le monoxyde d'azote
3. Qu'est-ce que le pentoxyde de dinitrogen
4. Comparaison côte à côte - monoxyde d'azote vs pentoxyde de dinitrogen sous forme tabulaire
5. Résumé
Qu'est-ce que le monoxyde d'azote?
Le monoxyde d'azote est un composé inorganique ayant la formule chimique no. Nous l'appelons oxyde nitrique car c'est un oxyde d'azote. C'est en fait un radical libre car il a un électron non apparié. De plus, c'est une molécule diatomique hétéronucléaire.
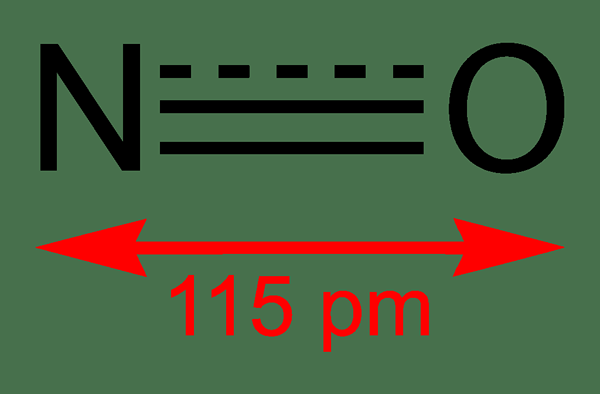
Figure 01: Structure du monoxyde d'azote et de la longueur de liaison entre n et o
La masse molaire de ce composé est de 30 g / mol. Il se produit comme un gaz incolore. De plus, son point de fusion est de -164 ° C tandis que le point d'ébullition est de -152 ° C, qui sont de très petites valeurs par rapport à celles des autres oxydes d'azote. Nous pouvons produire ce radical libre via l'oxydation de l'ammoniac à 850 ° C en présence d'un catalyseur en platine. Cependant, à l'échelle de laboratoire, nous pouvons le préparer par la réduction de l'acide nitrique dilué avec du cuivre.
Qu'est-ce que le pentoxyde de dinitrogen?
Le pentoxyde de dinitrogen est un composé inorganique ayant la formule chimique n2O5. Nous l'appelons le pentoxyde d'azote. C'est un oxyde d'azote binaire. De plus, il est instable et peut agir comme un oxydant dangereux. La masse molaire du composé est 108.01 g / mol. Il se produit un solide de couleur blanche.

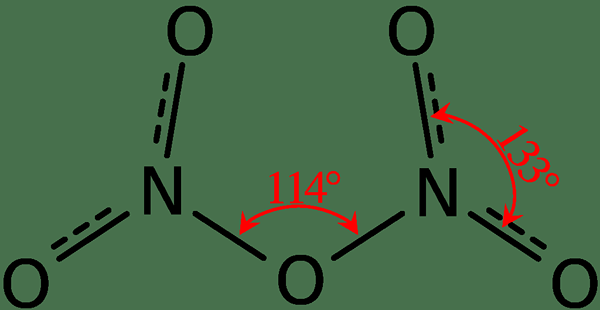
Figure 02: Structure du pentoxyde de dinitrogen
De plus, le point de fusion de ce composé est de 41 ° C et, à 47 ° C, ce composé subit une sublimation. Ce composé réagit avec l'eau, donnant de l'acide nitrique. De plus, la forme moléculaire de la molécule pentoxyde de dinitrogen est planaire. Nous pouvons produire ce composé via la déshydratation de l'acide nitrique avec du phosphore pentoxyde.
Quelle est la différence entre le monoxyde d'azote et le pentoxyde de dinitrogen?
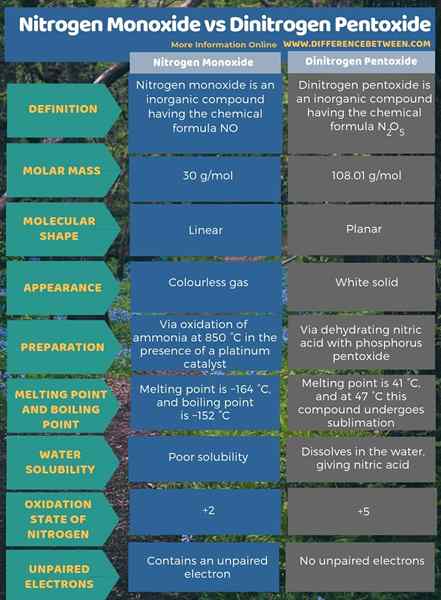
Le monoxyde d'azote est un composé inorganique ayant la formule chimique no tandis que le pentoxyde de dinitrogen est un composé inorganique ayant la formule chimique N2O5. La principale différence entre le monoxyde d'azote et le pentoxyde de dinitrogen est que le monoxyde d'azote est un gaz incolore tandis que le pentoxyde de dinitrogen est un solide blanc. De plus, nous pouvons produire du monoxyde d'azote via l'oxydation de l'ammoniac à 850 ° C en présence d'un catalyseur en platine. Cependant, la production de pentoxyde de dinitrogen est via la déshydratation de l'acide nitrique avec du pentoxyde de phosphore. Lorsque vous envisagez la forme moléculaire, le monoxyde d'azote est linéaire tandis que le pentoxyde de dinitrogen est planaire.
Résumé - monoxyde d'azote vs pentoxyde de dinitrogen
Le monoxyde d'azote est un composé inorganique ayant la formule chimique no tandis que le pentoxyde de dinitrogen est un composé inorganique ayant la formule chimique N2O5. La principale différence entre le monoxyde d'azote et le pentoxyde de dinitrogen est que le monoxyde d'azote est un gaz incolore tandis que le pentoxyde de dinitrogen est un solide blanc.
Référence:
1. Mowry, Curtis et al. «Activités de caractérisation des matériaux pour« Emmenez nos fils et filles à la journée de travail »2013." Jan. 2013, doi: 10.2172/1096449.
Image gracieuseté:
1. «Nitric-oxyde-2d» par yiny. - Propre travail (domaine public) via Commons Wikimedia
2. «Dinitrogen Pentoxyde» par Krishnavedala - Propre travaux (domaine public) via Commons Wikimedia


