Différence entre la réaction NABH4 et LIALH4
Le différence clé Entre la réaction NABH4 et LIALH4 est que NABH4 est un agent réducteur faible, tandis que LIALH4 est un agent réducteur fort.
NABH4 et LIALH4 réduisent les agents. Ce sont les sources les plus courantes de nucléophiles hydrure que nous utilisons dans les réactions de synthèse organique. Le nom de NABH4 est du borohydride de sodium tandis que le nom de LIALH4 est un hydrure d'aluminium au lithium.
CONTENU
1. Aperçu et différence clé
2. Quelle est la réaction NABH4
3. Qu'est-ce que la réaction lialh4
4. Comparaison côte à côte - réaction NABH4 vs lialh4 sous forme tabulaire
5. Résumé
Quelle est la réaction NABH4?
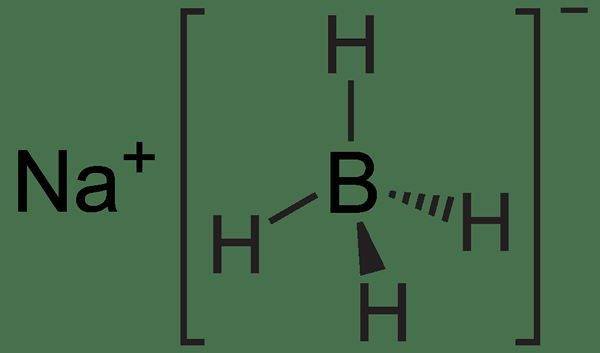
La réaction NABH4 est un type de réaction redox où NABH4 est l'agent réducteur. La formule chimique NABH4 représente le borohydride de sodium. C'est l'une des sources les plus courantes de nucléophiles hydrure. Ce composé a une liaison métal-hydrogène polaire. Par conséquent, pendant la réaction redox, nous ne pouvons pas trouver l'anion hydrure; Ainsi, ce réactif sert de source d'hydrure en raison de la présence de cette liaison métal-hydrogène. Cependant, lorsque nous comparons NABH4 avec LIALH4, la liaison métal-hydrogène de LIALH4 est plus polaire; Ainsi, c'est un agent réducteur plus fort que NABH4. Cela est principalement dû au fait que l'aluminium dans lialH4 est plus électronégatif que le bore dans NABH4.
Le borohydride de sodium peut réduire de nombreux composés carbonyle organiques. En règle générale, cette substance est utilisée en laboratoire pour convertir une cétone ou un aldéhyde en alcool. De plus, les réactions de NABH4 peuvent réduire efficacement les chlorures d'acyle, les anhydrides, les thioesters et les imines à température ambiante. De plus, NABH4 réagit avec l'eau et les alcools, formant l'hydrogène gazeux et un sel de borate.

Figure 01: Structure chimique de NABH4
De plus, dans les réactions NABH4, un alcool (comme le méthanol ou l'éthanol) est utilisé comme solvant pour la réduction des cétones ou des aldéhydes. Cependant, la réactivité de NABH4 peut être améliorée ou augmentée par différents composés tels que le méthanol.
Qu'est-ce que la réaction lialh4?
LialH4 est un type de réaction redox où lialH4 est l'agent réducteur. La formule chimique LIALH4 signifie Hydrure d'aluminium au lithium. Il a quatre liaisons métal-hydrogène qui sont très polaires en raison de la différence d'électronégativité entre le lithium et les atomes d'hydrogène. Cela fait du composé un agent réducteur fort. De plus, ce composé existe comme solide à température ambiante où il est extrêmement réactif vers l'eau et libère l'hydrogène gazeux lors de la réaction avec l'eau. Cette réaction est très dangereuse en raison de la forte réactivité du mélange réactionnel.
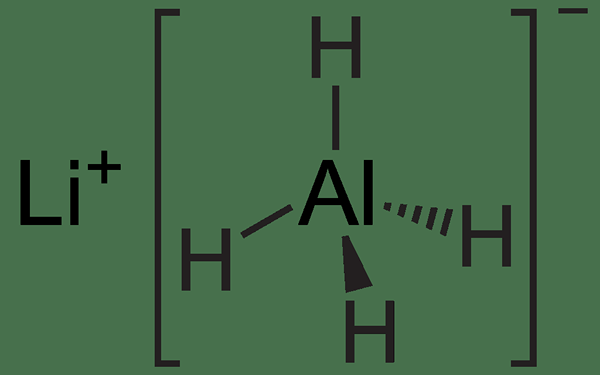
Figure 02: Structure chimique de LIALH4
LIALH4 peut convertir les esters, les acides carboxyliques, les chlorures d'acyle, les aldéhydes et les cétones en leur alcool correspondant. De plus, il peut convertir les amides, les composés de nitrile, les azides et les composés nitro en amines correspondantes.
Quelle est la différence entre la réaction NABH4 et LIALH4?
NABH4 et LIALH4 sont les agents réducteurs les plus courants en chimie organique. La principale différence entre NABH4 et LIALH4 est que NABH4 est un agent réducteur faible, tandis que LialH4 est un agent réducteur fort. En comparant NABH4 avec LIALH4, la liaison métal-hydrogène de LIALH4 est plus polaire; Ainsi, c'est un agent réducteur plus fort que NABH4. Cela est principalement dû au fait que l'aluminium dans lialH4 est plus électronégatif que le bore dans NABH4.
L'infographie ci-dessous donne une comparaison détaillée liée à la différence entre NABH4 et LIALH4.
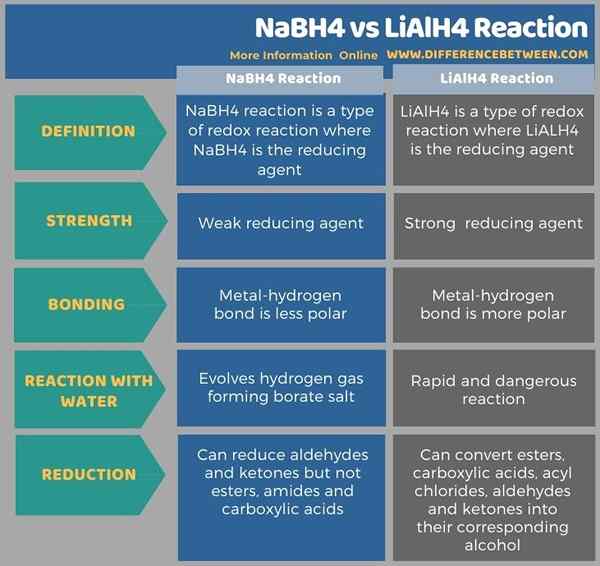
Résumé - Réaction NABH4 vs lialh4
Un agent réducteur est une substance chimique qui peut réduire une autre substance tout en s'oxydant. NABH4 et LIALH4 sont les agents réducteurs les plus courants en chimie organique. La principale différence entre NABH4 et LIALH4 est que NABH4 est un agent réducteur faible, tandis que LialH4 est un agent réducteur fort.
Référence:
1. Welker, Martin. «Organic Chemistry II." 3. Réductions utilisant NABH4, LIALH4 | Chimie organique II. N.p., n.d. la toile. 26 juin 2020.
Image gracieuseté:
1. «Borohydride de sodium» par Kemikungen - Propre travaux (domaine public) via Commons Wikimedia
2. «Hydrure de lithium en aluminium» par Kemikungen - Propre travaux (domaine public) via Commons Wikimedia


