Différence entre la théorie orbitale moléculaire et la théorie de l'hybridation
Le différence clé entre la théorie orbitale moléculaire et la théorie de l'hybridation est que La théorie orbitale moléculaire décrit la formation d'orbitales de liaison et anti-liaison, tandis que la théorie de l'hybridation décrit la formation d'orbitales hybrides.
Il existe différentes théories développées pour déterminer les structures électroniques et orbitales des molécules. La théorie VSEPR, la théorie de Lewis, la théorie des liaisons de valence, la théorie de l'hybridation et la théorie orbitale moléculaire sont des théories si importantes. La théorie la plus acceptable d'entre eux est la théorie orbitale moléculaire.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la théorie orbitale moléculaire
3. Qu'est-ce que la théorie de l'hybridation
4. Comparaison côte à côte - théorie orbitale moléculaire vs théorie de l'hybridation
5. Résumé
Qu'est-ce que la théorie orbitale moléculaire?
La théorie orbitale moléculaire est une technique pour décrire la structure électronique des molécules en utilisant la mécanique quantique. C'est le moyen le plus productif d'expliquer la liaison chimique dans les molécules. Discutons de cette théorie en détail.
Tout d'abord, nous devons savoir quelles sont les orbitales moléculaires. Une liaison chimique se forme entre deux atomes lorsque la force d'attraction nette entre deux noyaux atomiques et les électrons entre eux dépasse la répulsion électrostatique entre deux noyaux atomiques. Fondamentalement, cela signifie que les forces d'attraction entre deux atomes devraient être plus élevées que les forces répulsives entre ces deux atomes. Ici, les électrons doivent exister dans une région appelée «région de liaison», pour former cette liaison chimique. Sinon, les électrons seront dans la «région anti-contrainte» qui aidera la force répulsive entre les atomes.
Cependant, si les exigences sont remplies et qu'une forme de liaison chimique entre deux atomes, alors les orbitales correspondantes impliquées dans la liaison sont appelées orbitales moléculaires. Ici, nous pouvons commencer avec deux orbitales de deux atomes et nous retrouver avec une orbite (l'orbitale moléculaire) qui appartient aux deux atomes.
Selon la mécanique quantique, les orbitales atomiques ne peuvent pas apparaître ou disparaître comme nous le souhaitons. Lorsque les orbitales interagissent les uns avec les autres, ils ont tendance à changer leurs formes en conséquence. Mais selon la mécanique quantique, ils sont libres de changer la forme mais doivent avoir le même nombre d'orbitales. Ensuite, nous devons trouver l'orbitale manquant. Ici, la combinaison en phase des deux orbitales atomiques rend l'orbitale de liaison tandis que la combinaison hors phase forme l'orbitale anti-liaison.
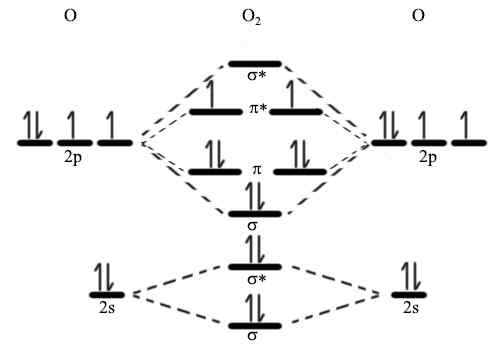
Figure 01: Diagramme orbital moléculaire
Les électrons de liaison occupent l'orbitale de liaison tandis que les électrons de l'orbitale anti-liaison ne participent pas à la formation de liaisons. Ces électrons s'opposent plutôt activement à la formation de la liaison chimique. L'orbitale de liaison a une énergie potentielle plus faible que l'orbitale anti-liaison. Si nous considérons une liaison sigma, la dénotation pour l'orbitale de liaison est σ et l'orbital anti-liaison est σ *. Nous pouvons utiliser cette théorie pour décrire la structure des molécules compliquées pour expliquer pourquoi certaines molécules n'existent pas (i.e. Il2) et l'ordre de liaison des molécules. Ainsi, cette description explique brièvement la base de la théorie orbitale moléculaire.
Qu'est-ce que la théorie de l'hybridation?
La théorie de l'hybridation est une technique que nous utilisons pour décrire la structure orbitale d'une molécule. L'hybridation est la formation d'orbitales hybrides en mélangeant deux orbitales atomiques ou plus. L'orientation de ces orbitales détermine la géométrie de la molécule. C'est une expansion de la théorie des liaisons de valence.
Avant la formation des orbitales atomiques, ils ont des énergies différentes, mais après la formation, toutes les orbitales ont la même énergie. Par exemple, une orbitale atomique S et une orbitale atomique P peuvent se combiner pour former deux orbitales SP. Les orbitales atomiques S et P ont des énergies différentes (énergie de S < energy of p). But after the hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

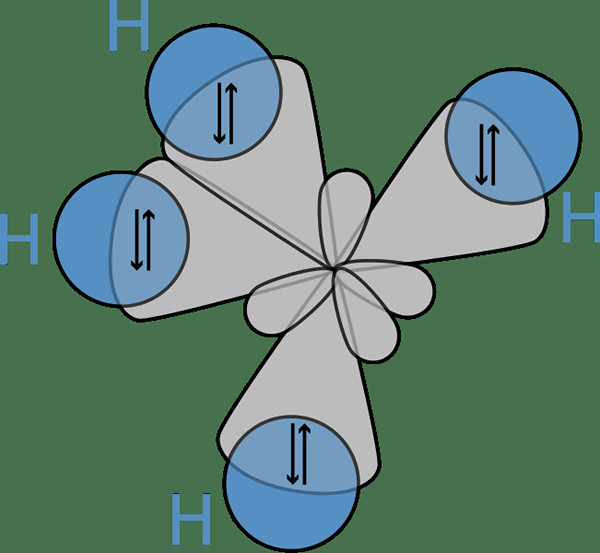
Figure 02: Bond entre les orbitales hybrides d'un atome de carbone et les orbitales S des atomes d'hydrogène
L'idée de l'hybridation a d'abord participé à la discussion parce que les scientifiques ont observé que la théorie des liaisons de valence ne prédisait pas correctement la structure de certaines molécules telles que CH4. Ici, bien que l'atome de carbone n'ait que deux électrons non appariés selon sa configuration d'électrons, il peut former quatre liaisons covalentes. Pour former quatre obligations, il doit y avoir quatre électrons non appariés.
La seule façon dont ils pouvaient expliquer ce phénomène était de penser que les orbitales S et P de l'atome de carbone fusionnent les uns avec les autres pour former de nouvelles orbitales appelées orbitales hybrides qui ont la même énergie. Ici, un s + trois p donne 4 sp3 orbitales. Par conséquent, les électrons remplissent uniformément ces orbitales hybrides (un électron par orbite hybride), obéissant à la règle du Hund. Ensuite, il y a quatre électrons pour la formation de quatre liaisons covalentes avec quatre atomes d'hydrogène.
Quelle est la différence entre la théorie orbitale moléculaire et la théorie de l'hybridation?
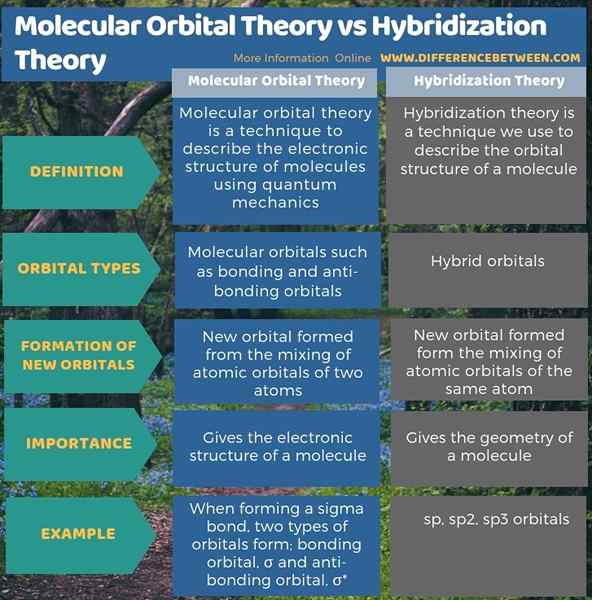
La théorie orbitale moléculaire est une technique pour décrire la structure électronique des molécules en utilisant la mécanique quantique. La théorie de l'hybridation est une technique que nous utilisons pour décrire la structure orbitale d'une molécule. Ainsi, la principale différence entre la théorie orbitale moléculaire et la théorie de l'hybridation est que la théorie orbitale moléculaire décrit la formation de liaisons et d'orbitales anti-liaison, tandis que la théorie de l'hybridation décrit la formation d'orbitales hybrides.
De plus, selon la théorie orbitale moléculaire, de nouvelles formes orbitales à partir du mélange d'orbitales atomiques de deux atomes tandis que dans la théorie de l'hybridation, de nouvelles formes orbitales forment le mélange d'orbitales atomiques du même atome. Par conséquent, c'est une autre différence entre la théorie orbitale moléculaire et la théorie de l'hybridation.
Résumé - Théorie orbitale moléculaire vs théorie de l'hybridation
La théorie orbitale moléculaire et la théorie de l'hybridation sont importantes pour déterminer la structure d'une molécule. La principale différence entre la théorie orbitale moléculaire et la théorie de l'hybridation est que la théorie orbitale moléculaire décrit la formation de liaisons et d'orbitales anti-liaison, tandis que la théorie de l'hybridation décrit la formation d'orbitales hybrides.
Référence:
1. "Hybridation.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
Image gracieuseté:
1. «O2MoleCulardiagramcr» par Tcreuter - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Hybridation CH4» par k. Aainsqatssi à l'anglais wikipedia (texte original: k. Aainsqatsi) - Propre travaux (texte original: auto-fabriqué) (domaine public) via Commons Wikimedia


