Différence entre l'acétate de méthyle et l'acétate d'éthyle
La principale différence entre l'acétate de méthyle et l'acétate d'éthyle est que L'acétate de méthyle a un groupe méthyle attaché à un groupe d'acétate tandis que l'acétate d'éthyle a un groupe éthylique attaché à un groupe d'acétate.
L'acétate est un anion dérivé de l'acide acétique (élimination de l'atome d'hydrogène dans le groupe d'acide carboxylique forme l'anion acétate). L'acétate de méthyle et l'acétate d'éthyle sont des composés organiques avec des propriétés chimiques et physiques étroitement apparentées.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acétate de méthyle
3. Qu'est-ce que l'acétate d'éthyle
4. Similitudes entre l'acétate de méthyle et l'acétate d'éthyle
5. Comparaison côte à côte - acétate de méthyle vs acétate d'éthyle sous forme tabulaire
6. Résumé
Qu'est-ce que l'acétate de méthyle?
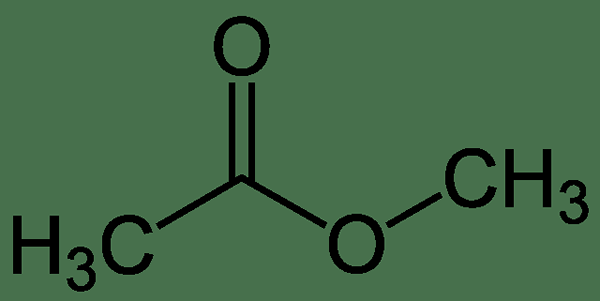
L'acétate de méthyle est un composé organique ayant la formule chimique ch3COOCH3. Ici, l'acétate (-cooch3) Le groupe est attaché à un groupe méthyle (-ch3). La masse molaire du composé est de 74 g / mol. Il est classé comme un ester carboxylate puisque l'acétate de méthyle est formé par l'interaction entre le groupe carboxylate et un groupe méthyle, formant une liaison ester.

Figure 1: acétate de méthyle
À température ambiante, l'acétate de méthyle est un liquide incolore avec une odeur parfumée. Il a également un goût fruité. Le point de fusion de ce composé est de -98 ° C tandis que le point d'ébullition est 56.9 ° C. Ce composé est modérément toxique. C'est aussi un liquide inflammable et a des utilisations comme solvant. De plus, c'est un solvant faiblement polaire et lipophile. À température ambiante, l'acétate de méthyle est mal soluble dans l'eau. Mais à des températures plus élevées, le composé a une solubilité en eau élevée. De plus, les vapeurs d'acétate de méthyle sont plus lourdes que l'air normal.
Qu'est-ce que l'acétate d'éthyle?
L'acétate d'éthyle est un composé organique ayant la formule chimique ch3Ch2COOCH3. La masse molaire de ce composé est de 88 g / mol. Il est classé comme un ester carboxylate puisque l'acétate d'éthyle est formé par l'interaction entre le groupe carboxylate et un groupe éthylique, formant une liaison ester. De plus, l'acétate d'éthyle est l'ester de l'éthanol et de l'acide acétique.
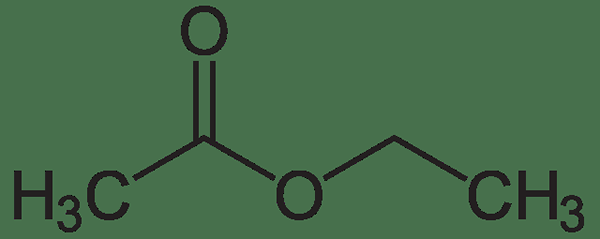
Figure 2: acétate d'éthyle
À température ambiante, l'acétate d'éthyle est un liquide incolore avec une odeur fruitée. Ce liquide est également largement utilisé comme solvant. La vapeur d'acétate d'éthyle est plus lourde que l'air normal. Il y a un large éventail d'applications pour ce liquide en raison de son faible coût, de son faible toxicité et de son odeur agréable.
Le point de fusion de l'acétate d'éthyle est de -83.6 ° C tandis que le point d'ébullition est de 77 ° C. C'est un liquide inflammable et un irritant. De plus, l'hydrolyse de l'acétate d'éthyle entraîne l'acide acétique et l'éthanol. Cette hydrolyse est un processus en deux étapes qui se produit en présence d'une base forte comme l'hydroxyde de sodium (NaOH). La première étape implique la formation d'éthanol et d'acétate de sodium tandis que la deuxième étape implique la conversion de l'acétate de sodium en acide acétique.
Quelles sont les similitudes entre l'acétate de méthyle et l'acétate d'éthyle?
- L'acétate de méthyle et l'acétate d'éthyle sont des liquides incolores à température ambiante avec une odeur fruitée et agréable.
- L'acétate de méthyle et l'acétate d'éthyle sont inflammables.
- Les deux composés sont des esters de carboxylate.
- L'acétate de méthyle et l'acétate d'éthyle sont utilisés comme solvants.
Quelle est la différence entre l'acétate de méthyle et l'acétate d'éthyle?
Acétate de méthyle vs acétate d'éthyle | |
| L'acétate de méthyle est un composé organique ayant la formule chimique ch3COOCH3. | L'acétate d'éthyle est un composé organique ayant la formule chimique ch3Ch2COOCH3. |
| Masse molaire | |
| La masse molaire de l'acétate de méthyle est de 74 g / mol. | La masse molaire d'acétate d'éthyle est de 88 g / mol. |
| Points de fusion et d'ébullition | |
| Le point de fusion de l'acétate de méthyle est de -98 ° C tandis que le point d'ébullition est 56.9 ° C. | Le point de fusion de l'acétate d'éthyle est de -83.6 ° C tandis que le point d'ébullition est de 77 ° C. |
| Toxicité | |
| L'acétate de méthyle est modérément toxique. | L'acétate d'éthyle est moins toxique que l'acétate de méthyle. |
| Utiliser comme solvant | |
| L'acétate de méthyle n'est utilisé que parfois comme solvant. | L'acétate d'éthyle est plus largement utilisé comme solvant. |
Résumé - acétate de méthyle vs acétate d'éthyle
L'acétate de méthyle et l'acétate d'éthyle sont des composés organiques avec des propriétés chimiques et physiques étroitement apparentées. La principale différence entre l'acétate de méthyle et l'acétate d'éthyle est que l'acétate de méthyle a un groupe méthyle attaché à un groupe d'acétate tandis que l'acétate d'éthyle a un groupe éthylique attaché à un groupe d'acétate.
Référence:
1. «Acétate de méthyle.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
2. «Acétate de méthyle.»Wikipedia, Wikimedia Foundation, 14 avril. 2018, disponible ici.
3. "Acétate d'éthyle.»Wikipedia, Wikimedia Foundation, 10 avril. 2018, disponible ici.
Image gracieuseté:
1. «Formule structurelle de méthyl-acétate V1» par Jü - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Essigsäurethylester» par NeuroKer (Talk) - Propre travaux (domaine public) via Commons Wikimedia


