Différence entre le méthane et le propane
Méthane vs propane
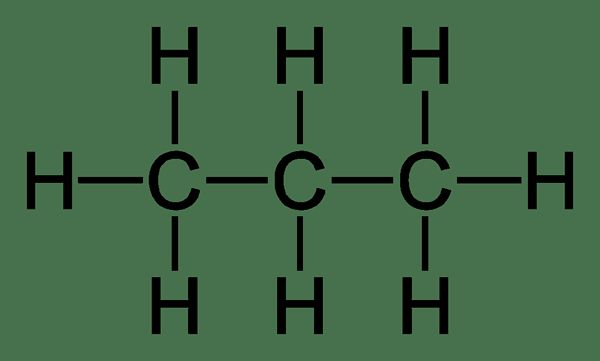
Le méthane et le propane sont les premier et les troisième membres de la famille Alcane. Leurs formules moléculaires sont ch4 et C3H8 respectivement. Le différence clé entre le méthane et le propane est leur structure chimique; Le méthane ne contient qu'un seul atome de carbone et quatre atomes d'hydrogène tandis que le propane contient trois atomes de carbone avec huit atomes d'hydrogène. Leurs propriétés chimiques et physiques varient en raison de cette différence.
Qu'est-ce que le méthane?
Méthane, également connu sous le nom carbane, gaz naturel, gaz de marais, tétrahydride en carbone, ou carbure d'hydrogène, est le plus petit membre de la famille Alcane. Sa formule chimique est ch4 (Quatre atomes d'hydrogène sont liés à un seul atome de carbone). C'est un composant majeur du gaz naturel. Le méthane est un gaz incolore, inodore et insipide. Il peut être facilement enflammé car sa vapeur est plus légère que l'air.
Le méthane peut être trouvé naturellement sous le sol et sous le fond marin. Le méthane atmosphérique est considéré comme un gaz à effet de serre. Le méthane se décompose en ch3- avec de l'eau dans l'atmosphère.
Qu'est-ce que le propane?
Le propane est le troisième membre de la famille Alcane. Sa formule moléculaire est C3H6, et la masse moléculaire équivaut à 44.10 g · mol−1. Il existe sous forme de gaz à la température et à la pression standard, mais il peut se comprimer dans un liquide transportable. Le propane n'existe pas naturellement, mais il est obtenu à partir du processus de raffinage du pétrole et en tant que sous-produit du traitement du gaz naturel.
Le propane est une substance gazeuse incolore, inodore, non toxique et inflammable et un odorant commercial est ajouté pour l'identification des fuites.
Quelle est la différence entre le méthane et le propane?
Caractéristiques du méthane et du propane
Structure moleculaire:
Méthane: La formule moléculaire du méthane est ch4, et c'est un exemple de molécule tétraédrique avec quatre liaisons C-H équivalentes (liaisons Sigma). Sa structure est donnée ci-dessous.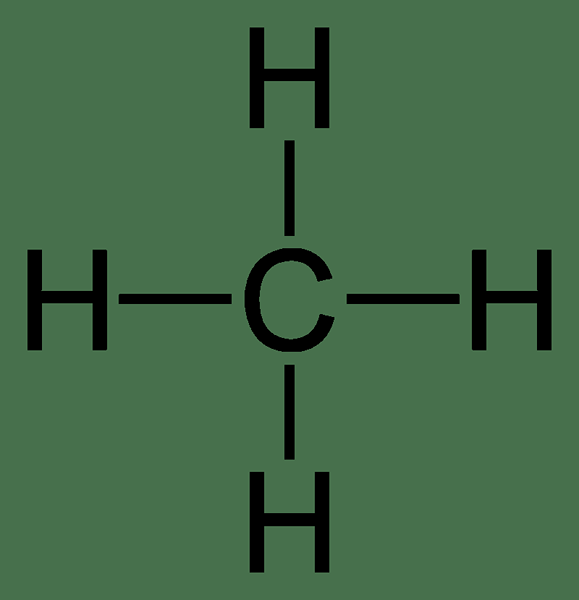
Propane: La formule moléculaire de l'éthane est C3H8, Et sa structure est donnée ci-dessous.
Propriétés chimiques:
La combustion:
Méthane: Le méthane brûle avec une flamme non bleu pâle produisant du dioxyde de carbone et de l'eau en présence d'un excès d'air ou d'oxygène. C'est une réaction hautement exothermique; Ainsi, c'est un excellent carburant.
Ch4(g) + 2o2 → CO2 + 2h2O + 890 kJ / mol
Il brûle partiellement en monoxyde de carbone (CO) en présence d'air insuffisant ou d'oxygène.
2ch4(g) + 3o2 → 2CO + 2H2O + énergie
Propane: Le propane brûle également de la même manière que les autres alcanes. Il brûle complètement en présence d'excès d'oxygène produisant de l'eau et du dioxyde de carbone.
C3H8 + 5o2 → 3co2 + 4h2O + 2220 kJ / mol
En l'absence d'oxygène suffisant pour le processus de combustion, il brûle incomplètement en monoxyde de carbone et / ou en carbone de suie.
2 c3H8 + 9o2 → 4CO2 + 2CO + 8H2O + chaleur
OU
C3H8 + 9o2 → 3C + 4h2O + chaleur
La combustion au propane est beaucoup plus propre que la combustion de l'essence, mais pas aussi propre que celle du gaz naturel.
Réactions:
Méthane: Le méthane présente des réactions de substitution avec des halogènes. Dans ces réactions, un ou plusieurs atomes d'hydrogène sont remplacés par un nombre égal d'atomes halogènes et il est appelé «halogénation."Il réagit avec le chlore (CL) et le brome (BR) en présence de la lumière du soleil.
Lorsqu'un mélange de méthane et de vapeur passe à travers un nickel chauffé (1000 K) soutenu à la surface de l'alumine, il peut produire de l'hydrogène.
Propane: Le propane présente également des réactions d'halogénation dans des conditions spéciales produisant différents produits dans diverses proportions.
Ch3-Ch2-Ch3 + CL2 → Ch3-Ch2-Ch2Cl (45%) + ch3-Chcl-ch3 (55%)
Ch3-Ch2-Ch3 + BR2 → Ch3-Ch2-Ch2Br (3%) + ch3-Chbr-ch3 (97%)
Utilisations de méthane et de propane
Méthane: Le méthane est utilisé dans de nombreux processus chimiques industriels (comme carburant, gaz naturel, gaz naturel liquéfié) et il est transporté comme un liquide réfrigéré.
Propane: Le propane est généralement utilisé comme carburant dans les moteurs, les fours, les poêles portables, les torches oxy-gaz, les chauffe-eau, les séchoirs à lessive et pour le chauffage dans les maisons. C'est l'un des gaz de pétrole liquéfié tels que le butane, le propylène et le butylène.
Définitions:
Réaction exothermique: Une réaction exothermique est une réaction chimique qui libère l'énergie par la lumière ou la chaleur.
Réactions de substitution: La réaction de substitution est une réaction chimique qui implique le déplacement d'un groupe fonctionnel dans un composé chimique et l'a remplacé par un autre groupe fonctionnel.
Références: «Réaction du propane avec l'oxygène!«Thecolt84« Reactions of Alkenes »Michigan State University Image Courtesty:« Propane »par Holger87 - Propre travaux (CC By-SA 3.0) Via Commons Wikimedia «Methane» (domaine public) via Commons Wikimedia

