Différence entre le méthane et l'éthane

Différence clé - méthane vs éthane
Le méthane et l'éthane sont les plus petits membres de la famille Alcane. Les formules moléculaires de ces deux composés organiques sont ch4 et C2H6 respectivement. Le différence clé entre le méthane et l'éthane est leur structure chimique; Une molécule d'éthane peut être considérée comme deux groupes méthyle rejoints comme un dimère de groupes méthyle. Les autres différences chimiques et physiques surviennent principalement en raison de cette différence structurelle.
Qu'est-ce que le méthane?
Le méthane est le plus petit membre de la famille alcane avec la formule chimique CH4 (Quatre atomes d'hydrogène sont liés à un seul atome de carbone). Il est considéré comme le composant principal du gaz naturel. Le méthane est un gaz incolore, inodore et insipide; aussi connu sous le nom carbane, gaz de marais, gaz naturel, tétrahydride en carbone, et carbure d'hydrogène. Il peut être facilement enflammé et sa vapeur est plus légère que l'air.
Le méthane se trouve naturellement sous le sol et sous le fond marin. Le méthane atmosphérique est considéré comme un gaz à effet de serre. Le méthane se décompose en ch3- avec de l'eau dans l'atmosphère. 
Qu'est-ce que l'éthane?
L'éthane est un composé gazeux incolore et inodore à la température et à la pression standard. Sa formule moléculaire et son poids moléculaire sont c2H6 et 30.07 g · mol−1 respectivement. Il est isolé du gaz naturel, comme sous-produit du processus de raffinage du pétrole. L'éthane est très important dans la production d'éthylène. 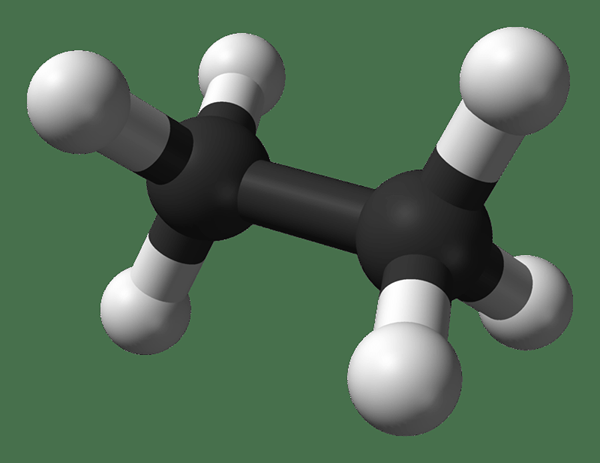
Quelle est la différence entre le méthane et l'éthane?
Caractéristiques du méthane et de l'éthane
Structure:
Méthane: Le formule moléculaire du méthane est Ch4, et c'est un exemple de molécule tétraédrique avec quatre liaisons C-H équivalentes (liaisons Sigma). L'angle de liaison entre les atomes H-C-H est de 109.50 et toutes les obligations C-H sont équivalentes, et elle est égale à 108.19 h.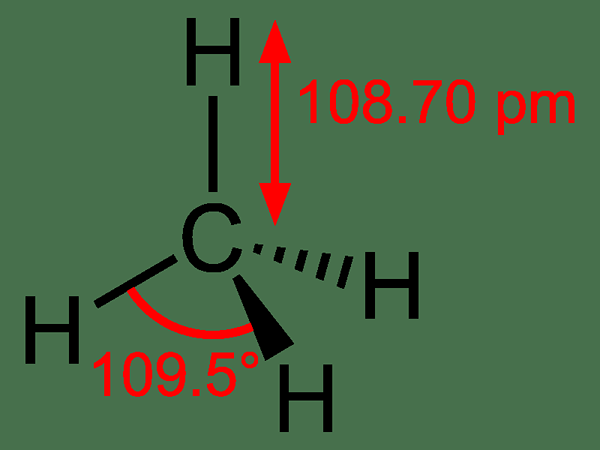
Éthane: Le formule moléculaire de l'éthane est C2H6, et c'est un hydrocarbure saturé car il ne contient pas plusieurs liaisons.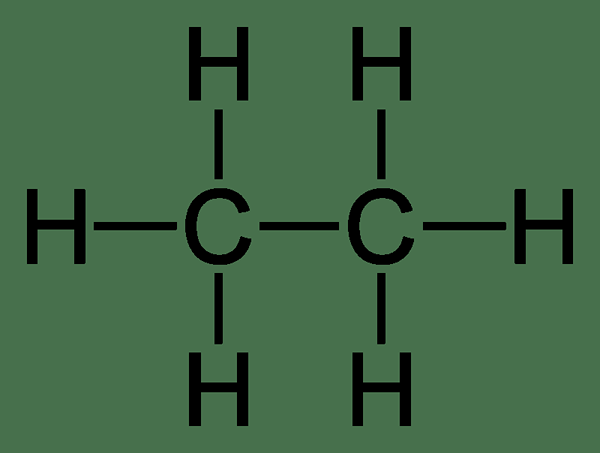
Propriétés chimiques:
Méthane:
La stabilité: Le méthane est une molécule chimiquement très stable qui ne réagit pas avec KMNO4, K2Croisement2O7, H2DONC4 ou hno3 sous des conditions normales.
La combustion: En présence d'un excès d'air ou d'oxygène, le méthane brûle avec une flamme non bleu pâle produisant du dioxyde de carbone et de l'eau. C'est une réaction hautement exothermique; Par conséquent, il est utilisé comme un excellent carburant. En présence d'air insuffisant ou d'oxygène, il brûle partiellement en monoxyde de carbone (CO).
Réactions de substitution: Le méthane présente des réactions de substitution avec des halogènes. Dans ces réactions, un ou plusieurs atomes d'hydrogène sont remplacés par un nombre égal d'atomes halogènes et il est appelé «halogénation."Il réagit avec le chlore (CL) et le brome (BR) en présence de la lumière du soleil.
Réaction avec la vapeur: Lorsqu'un mélange de méthane et de vapeur passe à travers un nickel chauffé (1000 K) soutenu à la surface de l'alumine, il peut produire de l'hydrogène.
Pyrolyse: Lorsque le méthane est chauffé à environ 1300 K, il est décomposé en noir de carbone et en hydrogène.
Éthane:
Réactions: Gaz d'éthane (ch3Ch3) réagit avec la vapeur de brome en présence de lumière pour former du bromoéthane (ch3Ch2BR) et le bromure d'hydrogène (HBR). Il s'agit d'une réaction de substitution; Un atome d'hydrogène dans l'éthane est remplacé par l'atome de brome.
Ch3Ch3 + BR2 à ch3Ch2Br + hbr
La combustion: La combustion complète de l'éthane produit 1559.7 kJ / mol (51.9 kJ / g) de chaleur, de dioxyde de carbone et d'eau.
2 c2H6 + 7 O2 → 4 CO2 + 6 H2O + 3120 kJ
Il peut également se produire sans excès d'oxygène, produisant un mélange de carbone amorphe et de monoxyde de carbone.
2 c2H6 + 3 O2 → 4 C + 6 H2O + énergie
2 c2H6 + 5 O2 → 4 Co + 6 H2O + énergie
2 c2H6 + 4 O2 → 2 C + 2 Co + 6 H2O + énergie etc.
Définitions:
Réactions de substitution: La réaction de substitution est une réaction chimique qui implique le déplacement d'un groupe fonctionnel dans un composé chimique et l'a remplacé par Un autre groupe fonctionnel.
Les usages:
Méthane: Le méthane est utilisé dans de nombreux processus chimiques industriels (comme carburant, gaz naturel, gaz naturel liquéfié) et il est transporté comme un liquide réfrigéré.
Éthane: L'éthane est utilisé comme carburant pour les moteurs et comme réfrigérant pour un système à extrême température. Il est expédié dans des cylindres en acier sous forme de gaz liquéfié sous sa propre pression de vapeur.
Références: «éthane». Wikipédia. N.p., 2016. la toile. 7 juin 2016. Khanna, Bhishm. «Quelles sont les propriétés chimiques du méthane ?". Conservateur.com. N.p., 2016. la toile. 7 juin 2016. «Methane | CH4 - PubChem ». Se publier.NCBI.NLM.NIH.gouvernement. N.p., 2016. la toile. 7 juin 2016. "Méthane". Wikipédia. N.p., 2016. la toile. 7 juin 2016. Image gracieuseté: «Modèle de molécule de méthane à balle et de bâton» par (domaine public) via les communes Wikimedia «Modèle de molécule de balle et de bâton de balle à l'éthane» Y Ben Mills - Propre travaux (domaine public) via Commons Wikimedia «Methane» par Jynto - propre travail, basé sur le dossier: méthane-crc-mw-dimensions-2d.PNG, (domaine public) via Commons Wikimedia «éthane» (domaine public) via les communes Wikimedia

