Différence entre les oxydes métalliques et non métalliques

Le différence clé entre les oxydes métalliques et non métal Les oxydes métalliques sont des composés de base tandis que les oxydes non métalliques sont des composés acides.
Les «oxydes» sont un grand groupe de composés qui ont des éléments chimiques liés essentiellement aux atomes d'oxygène. Cependant, les gaz nobles ne forment pas ces composés en raison de leur nature inerte et de leur stabilité plus élevée. La plupart des métaux et des non-métaux forment des oxydes avec différents états d'oxydation tandis que certains autres éléments chimiques forment des oxydes avec un état d'oxydation fixe; Par exemple, le magnésium ne forme que l'oxyde de magnésium ayant la formule chimique MgO tandis que le vanadium forme divers oxydes tels que v2O3 et V2O5.
CONTENU
1. Aperçu et différence clé
2. Que sont les oxydes métalliques
3. Que sont les oxydes non métalliques
4. Comparaison côte à côte - métal vs oxydes non métalliques sous forme tabulaire
5. Résumé
Que sont les oxydes métalliques?
Les oxydes métalliques sont des composés chimiques inorganiques contenant des métaux liés essentiellement avec les atomes d'oxygène. Dans ces composés, l'oxygène est essentiellement l'anion du composé ayant l'état d'oxydation -2. Par conséquent, le métal est le cation du composé. Les métaux qui forment des oxydes se trouvent dans le groupe de métaux alcalins (éléments du groupe 1), les métaux terrestres alcalins (éléments du groupe 2) et les éléments de blocs D, y compris les métaux de transition. Ils forment un oxyde ionique, ce qui signifie que les composés d'oxyde qu'ils forment ont une nature ionique. Mais certains éléments chimiques forment des oxydes de nature covalente, en particulier les éléments chimiques montrant des états d'oxydation plus élevés.

Figure 01: Oxyde d'argent (II)
La plupart du temps, les oxydes métalliques sont des solides cristallins et sont souvent des composés de base. Par conséquent, ils peuvent réagir avec l'eau pour donner une solution alcaline. De plus, ils peuvent réagir avec les acides pour former des sels via des réactions de neutralisation. Bien que presque tous les oxydes aient de l'oxygène avec un état d'oxydation -2, il peut y avoir des oxydes avec des états d'oxydation -1 et -1/2; Nous les appelons respectivement des peroxydes et des superoxydes. Le nombre d'atomes d'oxygène dans les composés dépend de l'état d'oxydation du métal.
Exemples d'oxydes métalliques:
- Oxyde de sodium (na2O)
- Oxyde de magnésium (MGO)
- Pentoxyde de vanadium (V2O5)
- Oxyde d'argent (il y a)
Que sont les oxydes non métalliques?
Les oxydes non métalliques sont des composés chimiques inorganiques contenant des non-métaux liés essentiellement avec les atomes d'oxygène. Par conséquent, ces composés contiennent principalement des éléments de bloc P car les éléments de bloc P sont les non-métaux que nous avons. Presque tous les oxydes non métalliques sont des composés covalents car ils ont tendance à partager des électrons avec d'autres atomes, ici, avec des atomes d'oxygène.
Ce sont des composés acides; Par conséquent, ils forment un acide lorsqu'ils sont dissous dans l'eau. Pour la même raison, ils peuvent réagir avec des bases pour former des sels via des réactions de neutralisation. De plus, ils peuvent former des oxyacides qui peuvent former des hydroxydes dans un milieu aqueux.

Figure 02: Le quart ou le dioxyde de silicone est un oxyde non métal
Exemples d'oxydes non métalliques:
- Dioxyde de soufre (donc2) et le trioxyde de soufre (donc3)
- Dioxyde de carbone (CO2) et le monoxyde de carbone (CO)
- Dioxyde de silicone (Sio2)
- Oxydes d'azote (n2O, non2, N2O5)
Quelle est la différence entre les oxydes métalliques et non métalliques?
Les oxydes métalliques sont des composés chimiques inorganiques contenant des métaux liés essentiellement avec des atomes d'oxygène tandis que les oxydes non métalliques sont des composés chimiques inorganiques contenant des non-métaux liés essentiellement avec les atomes d'oxygène. C'est la différence fondamentale entre les oxydes métalliques et non métalliques. De plus, ces composés diffèrent les uns des autres en fonction de leur nature chimique. Ainsi, la principale différence entre les oxydes métalliques et non métalliques est que les oxydes métalliques sont des composés de base tandis que les oxydes non métal.
De plus, il existe également une différence entre les oxydes métalliques et non métalliques dans leur structure chimique. La plupart du temps, les oxydes métalliques sont des composés ioniques tandis que les oxydes non métalliques sont des composés covalents. De plus, les oxydes métalliques ont tendance à réagir avec l'eau pour former des solutions alcalines mais les oxydes non métalliques ont tendance à réagir avec l'eau pour former des solutions acides. C'est une autre différence significative entre les oxydes métalliques et non métalliques. De plus, les oxydes métalliques réagissent avec les acides pour former des sels alors que les oxydes non métalliques réagissent avec des bases pour former des sels.
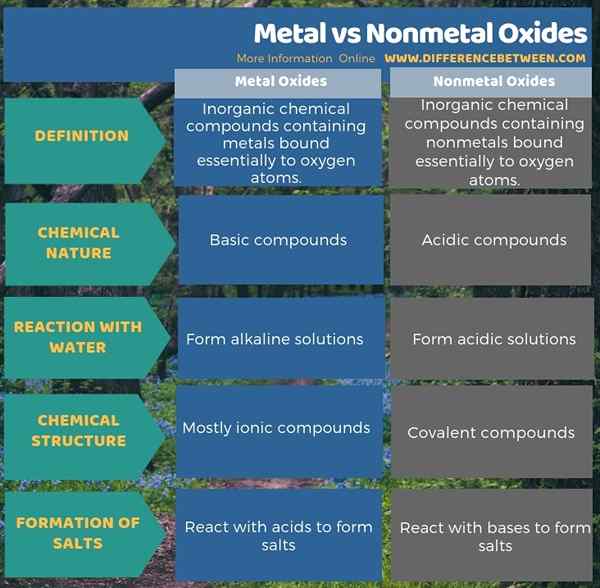
Résumé - Métal vs oxydes non métalliques
Les oxydes sont des composés chimiques ayant un métal ou un non-métal lié avec un ou plusieurs atomes d'oxygène. La principale différence entre les oxydes métalliques et non métalliques est que les oxydes métalliques sont des composés de base tandis que les oxydes non métal.
Référence:
1. Zumdahl, Steven S. "Oxyde.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 mai 2018. Disponible ici
Image gracieuseté:
1.«Silver (i) -oxyde-échantillon» par Benjah-Bmm27 - propre travail, (domaine public) via Commons Wikimedia
2.«Quartz Oisan» par Didier Descouens - Propre travaux, (CC BY-SA 4.0) via Commons Wikimedia


