Différence entre le point de fusion et le point de congélation

Le différence clé entre le point de fusion et le point de congélation est que Le point de fusion est la température à laquelle un solide ira à l'état liquide tandis que le point de congélation est le point où tout liquide changera son état en un solide.
Les changements de phase sont des processus qui impliquent une libération d'énergie ou un gain d'énergie. Le point de fusion et le point de congélation sont des points auxquels les changements de phase se produisent. Avec ceux-ci, de nombreuses autres propriétés du matériau peuvent également changer. Théoriquement, le point de congélation et le point de fusion d'un matériau sont les mêmes, mais parfois pour des substances particulières, les deux valeurs diffèrent les unes des autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le point de fusion
3. Qu'est-ce que le point de congélation
4. Comparaison côte à côte - point de fusion vs point de congélation dans la forme tabulaire
5. Résumé
Qu'est-ce que le point de fusion?
Le point de fusion est la température à laquelle un solide se transformera en son état liquide. C'est une propriété physique que nous pouvons utiliser pour identifier un composé. Lorsqu'un solide se transforme en un stade liquide, un changement de phase se produit. Il se produit à une température caractéristique pour une pression donnée. Pour cela, nous devons fournir l'énergie requise.
Le changement de phase absorbe l'énergie / la chaleur (endothermique) lorsque vous passez du solide au liquide. La plupart du temps, cette énergie est fournie sous forme de chaleur. La chaleur est nécessaire pour augmenter la température du solide à son état de point de fusion. De plus, la substance a besoin de l'énergie pour se faire fondre. Nous appelons cette chaleur énergétique de fusion; C'est un type de chaleur latente.
La chaleur latente est la chaleur absorbée ou libérée d'une substance pendant un changement de phase. Ces changements de chaleur ne provoquent pas de changements de température car ils sont absorbés ou libérés. Par conséquent, au point de fusion, la substance absorbe la chaleur, mais la température ne changera pas en conséquence. Thermodynamiquement, au point de fusion, le changement de l'énergie libre de Gibbs est nul. L'équation suivante est valable pour un matériau au point de fusion. Cela montre que la température ne change pas, mais l'enthalpie et l'entropie du matériau changent.
ΔS = ΔH / T
Puisque la substance absorbe l'énergie, l'enthalpie augmente au point de fusion. À l'état solide, les particules sont bien commandées et ont moins de mouvement. Mais à l'état liquide, leur nature aléatoire augmente. Par conséquent, au point de fusion, l'entropie augmente. Selon la pression, il y a un point de fusion spécifique pour un matériau donné. Nous ne pouvons déterminer que les points de fusion pour les solides.
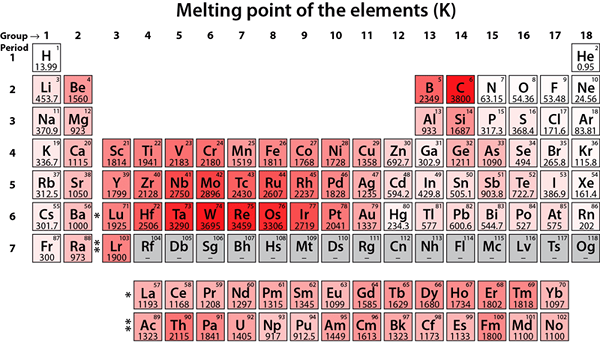
Figure 01: Points de fusion de différents éléments chimiques
En laboratoire, nous pouvons utiliser de nombreuses techniques pour déterminer le point de fusion. L'utilisation d'un appareil de point de fusion est très facile. Nous pouvons mettre du solide finement en poudre dans un capillaire dans lequel une extrémité est scellée. Ensuite, nous devons mettre l'extrémité scellée qui contient le solide dans l'appareil. Ici, la fin devrait toucher le métal à l'intérieur. Par la suite, nous pouvons observer le solide à travers la fenêtre de longerage de l'appareil. Il y a aussi un thermomètre pour enregistrer la température. Lorsque la température augmente progressivement, le métal chauffera et, le solide dans le capillaire chauffera également. Nous pouvons observer le point auquel la fusion commence et termine. Et, cette gamme correspond au point de fusion. Le point de fusion de l'eau est 0 ° C. Le tungstène a le point de fusion le plus élevé, qui est de 3410 ° C.
Qu'est-ce que le point de congélation?
Le point de congélation est la température à laquelle tout liquide changera son état en un solide. La température du point de fusion et le point de congélation pour un matériau est plus ou moins la même valeur. Par exemple, l'eau se transforme en glace à 0 ° C et son point de fusion est également 0 ° C. Plus précisément, le point de congélation décrit le changement de phase de matière.

Figure 02: Le congélation de l'eau forme de la glace
De plus, le processus de gel d'une substance diminue l'entropie. Il y a un terme en chimie comme «dépression de point de congélation» qui explique comment la présence d'un soluté non volatile dans une solution diminue la température de congélation du solvant.
Quelle est la différence entre le point de fusion et le point de congélation?
Le point de fusion et le point de congélation sont des directions opposées du même changement de phase. La principale différence entre le point de fusion et le point de congélation est que le point de fusion est la température à laquelle un solide ira à l'état liquide tandis que le point de congélation est le point où tout liquide changera son état en solide. De plus, il existe également une différence entre le point de fusion et le point de congélation en termes de changement d'entropie; Tout en faisant fondre un solide, l'entropie augmente, mais en congélation, l'entropie diminue. De plus, bien que théoriquement, les températures de point de fusion et de point de congélation sont similaires pour un matériau donné, pratiquement ils varient légèrement.
Résumé - Point de fusion vs point de congélation
Le point de fusion et le point de congélation sont deux propriétés physiques des substances. La principale différence entre le point de fusion et le point de congélation est que le point de fusion est la température à laquelle un solide ira à l'état liquide tandis que le point de congélation est le point où tout liquide changera son état en solide.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Quel est le point de congélation de l'eau?”Thoughtco, oct. 5, 2018, disponible ici.
Image gracieuseté:
1. «Point de fusion des éléments (k)» par Albris - propre travail (CC BY-SA 4.0) via Commons Wikimedia
2. «1550739» (CC0) via pxhere


