Différence entre Lyman et Balmer Series
Le différence clé Entre Lyman et la série Balmer est que La série Lyman se forme lorsqu'un électron excité atteint le niveau d'énergie n = 1 tandis que la série Balmer se forme lorsqu'un électron excité atteint le niveau d'énergie n = 2.
La série Lyman et la série Balmer sont nommées d'après les scientifiques qui les ont trouvés. Le physicien Theodore Lyman a découvert la série Lyman tandis que Johann Balmer a découvert la série Balmer. Ce sont des types de lignes spectrales d'hydrogène. Ces séries de deux lignes proviennent des spectres d'émission de l'atome d'hydrogène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la série Lyman
3. Qu'est-ce que la série Balmer
4. Comparaison côte à côte - série Lyman vs Balmer sous forme tabulaire
5. Résumé
Qu'est-ce que la série Lyman?
La série Lyman est une série de lignes spectrales d'hydrogène qui se forme lorsqu'un électron excité arrive au niveau d'énergie n = 1. Et, ce niveau d'énergie est le niveau d'énergie le plus bas de l'atome d'hydrogène. La formation de cette série de lignes est due aux lignes d'émission ultraviolette de l'atome d'hydrogène.

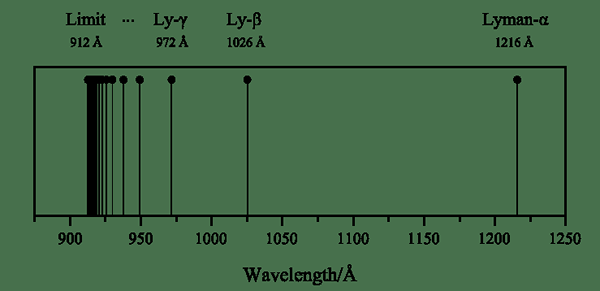
Figure 01: série Lyman
De plus, nous pouvons nommer chaque transition à l'aide de lettres grecques; La transition d'un électron excité de n = 2 à n = 1 est la ligne spectrale alpha Lyman, de n = 3 à n = 1 est Lyman Beta, et ainsi de suite. Le physicien Theodore Lyman a trouvé la série Lyman en 1906.
Qu'est-ce que la série Balmer?
La série Balmer est une série de lignes spectrales d'hydrogène qui se forme lorsqu'un électron excité arrive au niveau d'énergie n = 2. De plus, cette série montre les lignes spectrales pour les émissions de l'atome d'hydrogène, et il a plusieurs lignes de balmer ultraviolets proéminentes ayant des longueurs d'onde qui sont plus courtes que 400 nm.

Figure 02: série Balmer
La série Balmer est calculée à l'aide de la formule Balmer, qui est une équation empirique découverte par Johann Balmer en 1885.
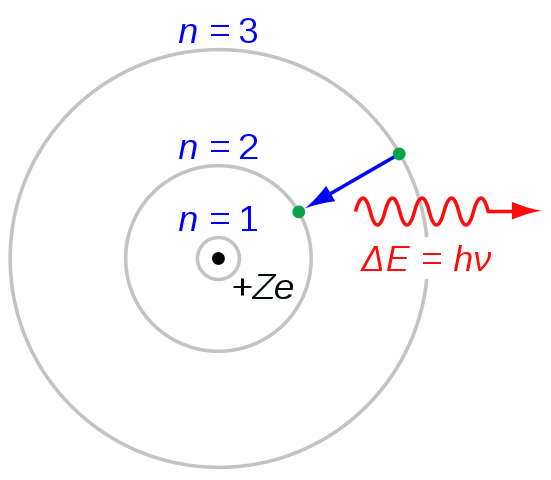
Figure 03: Transition électronique pour la formation de la série Balmer
Lorsque nous nommons chaque ligne de la série, nous utilisons la lettre «H» avec des lettres grecques. Par exemple, de n = 3 à n = 2, la transition donne lieu à la ligne H-alpha, de n = 4 à n = 2 donne lieu à la ligne H-beta et ainsi de suite. La lettre «H» représente «l'hydrogène». Lorsque vous envisagez les longueurs d'onde, la première ligne spectrale est dans la plage visible du spectre électromagnétique. Et, cette première ligne a une couleur rouge vif.
Quelle est la différence entre Lyman et Balmer Series?
Les séries Lyman et Balmer sont des séries de lignes spectrales d'hydrogène qui proviennent de spectres d'émission d'hydrogène. La principale différence entre Lyman et la série Balmer est que la série Lyman se forme lorsqu'un électron excité atteint le niveau d'énergie n = 1 tandis que la série Balmer se forme lorsqu'un électron excité atteint le niveau d'énergie n = 2. Certaines lignes de la série Blamer se trouvent dans la plage visible du spectre électromagnétique. Mais, la série Lyman est dans la plage de longueurs d'onde UV.
La série Lyman et la série Balmer ont été nommées d'après les scientifiques qui les ont trouvés. Le physicien Theodore Lyman a trouvé la série Lyman tandis que Johann Balmer a trouvé la série Balmer. Lorsque vous nommiez les lignes des spectres, nous utilisons une lettre grecque. Pour les lignes de la série Lyman, les noms sont comme Lyman Alpha, Lyman Beta et ainsi de suite tandis que pour les lignes de la série Balmer, les noms sont comme H-alpha, H-beta, etc.
L'infographie ci-dessous résume la différence entre Lyman et la série Balmer.

Résumé - Lyman vs Balmer Series
Les séries Lyman et Balmer sont des séries de lignes spectrales d'hydrogène qui proviennent de spectres d'émission d'hydrogène. La principale différence entre Lyman et la série Balmer est que la série Lyman se forme lorsqu'un électron excité atteint le niveau d'énergie N = 1, tandis que la série Balmer se forme lorsqu'un électron excité atteint le niveau d'énergie n = 2. Le physicien Theodore Lyman a découvert la série Lyman tandis que Johann Balmer a découvert la série Balmer.
Référence:
1. «Série Balmer.»Wikipedia, Wikimedia Foundation, 21 octobre. 2019, disponible ici.
2. «Série Lyman.»Wikipedia, Wikimedia Foundation, 7 octobre. 2019, disponible ici.
Image gracieuseté:
1. «Lymanseries» par Lymanseries1.GIF: le téléchargeur original était adrifer à EN.Wikipediaderivative Work: Orangedog (Talk • Contribs) - Lymanseries1.gifvectorised de l'original. La précision a également réduit en accord avec la plupart des sources., (CC BY-SA 3.0) via Commons Wikimedia
2. «Spectre visible de l'hydrogène» par Jan Homann - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
3. «Bohr Atom Model» par Jabberwok (CC BY-SA 3.0) via Commons Wikimedia


