Différence entre la loi de la composition constante et la loi de plusieurs proportions
Le différence clé entre la loi de la composition constante et la loi de plusieurs proportions Selon la loi de la composition constante, la même proportion d'échantillons consiste toujours en la même proportion d'éléments par masse, tandis que selon la loi de plusieurs proportions, si deux éléments se lient entre eux formant plus d'un composé chimique, alors le rapport entre les masses du deuxième élément qui se combine avec une masse fixe du premier élément a des rapports de petits nombres entiers.
La loi des compositions constantes et la loi des proportions multiples sont des théories en chimie physique qui sont utilisées pour expliquer la stoechiométrie en chimie. La stoechiométrie est la mesure des quantités relatives de réactifs et de produits dans une réaction chimique.
CONTENU
1. Aperçu et différence clé
2. Quelle est la loi de la composition constante
3. Quelle est la loi des proportions multiples
4. Comparaison côte à côte - Loi de la composition constante vs loi de plusieurs proportions sous forme tabulaire
5. Résumé
Quelle est la loi de la composition constante?
La loi de la composition constante indique que les échantillons d'un composé contiennent toujours la même proportion d'éléments par masse. Nous pouvons également nommer cette loi comme la loi des proportions définies. Cette loi décrit qu'un composé donné contiendra toujours les mêmes éléments dans les mêmes proportions de la masse.
Par exemple, que ce soit de l'eau du robinet ou de l'eau de mer, une molécule d'eau contiendra toujours des éléments d'hydrogène et d'oxygène dans les proportions suivantes. La formule chimique d'une molécule d'eau est H2O, et la masse molaire de cette molécule est de 18 g / mol. Par conséquent, une mole d'eau contient 18 g de H2O. Le rapport entre H et O dans la molécule d'eau est de 2: 1. En conséquence, la fraction de masse de l'hydrogène dans l'eau = (2g / 18g) x 100% = 11.11% et la fraction de masse de l'oxygène = (16g / 18g) x 100% = 88.89%. Ces fractions sont constantes et ne modifient pas selon la source d'eau et la méthode de séparation.
La loi de la composition constante dépend du fait que tout atome du même élément (atomes ayant le même nombre atomique) est similaire les uns aux autres. Compte tenu de l'exemple ci-dessus, l'hypothèse est que tout atome d'hydrogène est similaire à un autre atome d'hydrogène et vice versa. Mais il peut également y avoir des exceptions. E.g. La composition isotopique d'un élément peut varier en fonction de la source. Par conséquent, la stoechiométrie montre des variations en fonction de la source des éléments.
Quelle est la loi des proportions multiples?
La loi de plusieurs proportions indique que lorsque deux éléments se combinent les uns avec les autres pour former plus d'un composé, les poids d'un élément qui se combinent avec un poids fixe de l'autre sont dans un rapport de petits nombres entiers.

Nous pouvons également appeler cette loi de la loi de Dalton parce que la loi a été élaborée par John Dalton en 1803. Comprenons cette loi en utilisant un exemple.
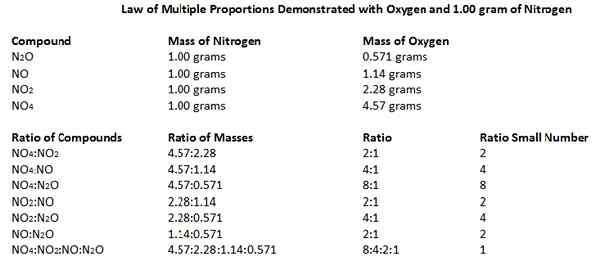
Les oxydes d'azote sont constitués d'atomes d'azote et d'oxygène. Nous pouvons identifier cinq oxydes différents d'azote qui existent: n2O, non, n2O3, NON2 et n2O5. Compte tenu des rapports de masse de N et O dans ces composés d'oxyde, 14 grammes d'atome d'azote se combinent avec 8, 16, 24, 32 et 40 grammes d'oxygène selon le rapport de masse, respectivement. Si nous prenons ces nombres aussi petits, nombres entiers, les rapports peuvent être donnés comme 1: 1, 1: 2, 1: 3, 1: 4 et 1: 5.
Quelle est la différence entre la loi de la composition constante et la loi de plusieurs proportions?
Selon la loi de la composition constante, la même proportion d'échantillons consiste toujours en la même proportion d'éléments par masse, tandis que selon la loi de plusieurs proportions, si deux éléments se lient à plus d'un composé chimique, alors le rapport entre les masses du deuxième élément qui se combine avec une masse fixe du premier élément a des rapports de petits nombres entiers. C'est donc la principale différence entre la loi de la composition constante et la loi de plusieurs proportions.

Résumé - Loi de la composition constante vs loi de plusieurs proportions
Selon la loi de la composition constante, la même proportion d'échantillons consiste toujours en la même proportion d'éléments par masse, tandis que selon la loi de plusieurs proportions, si deux éléments se lient à plus d'un composé chimique, alors le rapport entre les masses du deuxième élément qui se combine avec une masse fixe du premier élément a des rapports de petits nombres entiers. Ainsi, c'est la différence entre la loi de la composition constante et la loi de proportions multiples.
Référence:
1. Helmenstine, Anne Marie. «Loi de la composition constante en chimie."Thoughtco, août. 26, 2020, disponible ici.
Image gracieuseté:
1. «Démonstration de la loi des proportions multiples» par Kenji Agari - propre travail (CC BY-SA 3.0) via Commons Wikimedia


