Différence entre la L-tyrosine et la tyrosine
L-tyrosine vs tyrosine
La principale différence entre la L-tyrosine et la tyrosine est la capacité de faire tourner la lumière polarisée plan. La tyrosine est un acide α-amino non essentiel à l'origine biologique. Il peut se produire sous deux formes d'isomères, en raison de la formation de deux énantiomères différents autour de l'atome de carbone chiral. Ceux-ci sont connus sous le nom de formes L et D ou équivalentes aux configurations gaucher et droitiers, respectivement. Ces formes L et D seraient optiquement actives, et tournent la lumière polarisée du plan dans une direction différente comme. Si la lumière polarisée plane tourne la tyrosine dans le sens antihoraire, alors la lumière révèle la lévorotation, et elle est connue sous le nom de L-tyrosine. Cependant, il convient de noter soigneusement ici que l'étiquetage D et L des isomères n'est pas identique que le marquage D et L.
Qu'est-ce que la tyrosine?
La tyrosine est un acide aminé non essentiel, qui est synthétisé dans notre corps à partir d'un acide aminé appelé phénylalanine. Il s'agit d'un composé organique biologiquement important composé d'amine (-nh2) et des groupes fonctionnels d'acide carboxylique (-COOH) avec une formule chimique C6H4(Oh) -ch2-CH (NH2) -Cooh. Les éléments clés de la tyrosine sont le carbone, l'hydrogène, l'oxygène et l'azote. La tyrosine est considérée comme un acide (alpha-) α-aminé car un groupe d'acide carboxylique et un groupe amino sont attachés au même atome de carbone dans le squelette de carbone. La structure moléculaire de la tyrosine est donnée sur la figure 1.
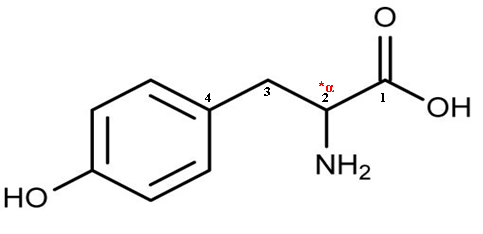
Figure 1: Structure moléculaire de la tyrosine (* L'atome de carbone est un atome de carbone chiral ou asymétrique et représente également l'atome d'alpha-carbone)
La tyrosine joue un rôle vital dans la photosynthèse des plantes. Il agit comme un élément constitutif de la synthèse de plusieurs neurotransmetteurs importants également connus sous le nom de produits chimiques cérébraux tels que l'épinéphrine, la noradrénaline et la dopamine. De plus, la tyrosine est essentielle pour produire du pigment de mélanine, qui est responsable de la teinte de la peau humaine. De plus, la tyrosine aide également aux fonctions des glandes surrénaliennes, thyroïdiennes et hypophysaires pour la production et la régulation de leurs hormones.
Qu'est-ce que L- tyrosine?
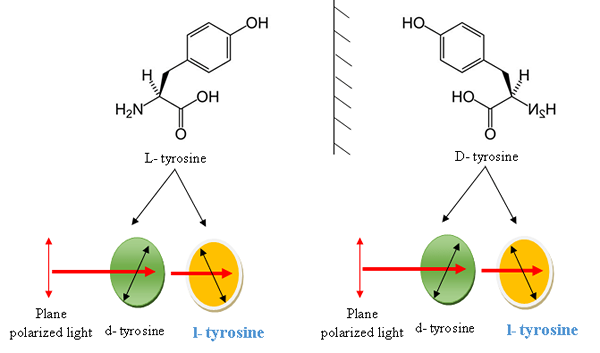
Tyrosine a quatre groupes différents autour de 2nd carbone, et c'est une configuration asymétrique. De plus, la tyrosine est considérée comme un acide aminé optiquement actif en raison de la présence de cet atome de carbone asymétrique ou chiral. Ces atomes de carbone asymétriques dans la tyrosine sont illustrés à la figure 1. Ainsi, la tyrosine peut produire des stéréoisomères, qui sont des molécules isomères qui ont la formule moléculaire similaire, mais varient dans les directions tridimensionnelles (3D) de leurs atomes dans l'espace. En biochimie, les énantiomères sont deux stéréoisomères qui sont des images miroir non superprimables l'une de l'autre. La tyrosine est disponible en deux formes d'énantiomères appelées configuration L et D et les énantiomères de la tyrosine sont donnés dans la figure 2.

Figure 2: Énantiomères de la tyrosine acide aminé. La forme en L des énantiomères de la tyrosine, les groupes COOH, NH2, H et R sont disposés autour de l'atome C asymétrique dans le sens horaire tandis que la forme D est disposée dans le sens anticipé. Les formes L et D de la tyrosine sont des molécules chirales qui peuvent faire tourner le plan de la lumière polarisée en différentes directions telles que les formes L et les formes D peuvent faire tourner la lumière polarisée plane à gauche (L-Forme) ou vers la droite (D- form).
La l-Tyrosine et la D- tyrosine sont des énantiomères les unes des autres et ont des caractéristiques physiques identiques, en dehors de la direction dans laquelle ils tournent la lumière polarisée. Cependant, la nomenclature de D et L n'est pas courante dans les acides aminés, y compris la tyrosine. De plus, ils ont une relation d'image miroir non superprimable, et ces images miroir peuvent faire pivoter la lumière polarisée en plan dans un degré similaire mais dans des directions différentes. L'isomère D et L de la tyrosine qui tourne la lumière polarisée plane dans le sens dans le sens des aiguilles d'une montre est appelée dextrorotatoire ou d-lysine que l'énantiomère est marqué (+). D'un autre côté, l'isomère D et L de la tyrosine qui fait pivoter la lumière polarisée plane dans le sens antihoraire est appelée étiquette de laevorotatoire ou de la L que l'énantiomère est marqué (-). Ces formes L et D de la tyrosine sont connues sous le nom d'isomères optiques (figure 2).
La L-tyrosine est la forme stable la plus disponible de la tyrosine et de la d-tyrosine est une forme synthétique de tyrosine qui peut être synthétisée à partir de la L-tyrosine par racémisation. L-Tyrosine joue un rôle significatif dans le corps humain dans la synthèse des neurotransmetteurs, de la mélamine et des hormones. Industriellement, la L-tyrosine est produite par un processus de fermentation microbienne. Il est principalement utilisé dans l'industrie pharmaceutique et alimentaire comme complément alimentaire ou additif alimentaire.
Quelle est la différence entre la L-tyrosine et la tyrosine?
La tyrosine et la l-Tyrosine ont des propriétés physiques identiques, mais ils tournent la lumière polarisée plane dans une direction différente. En conséquence, la l-tyrosine peut avoir des effets biologiques et des propriétés fonctionnelles sensiblement différentes. Cependant, des recherches très limitées ont été effectuées afin de distinguer ces effets biologiques et ces propriétés fonctionnelles. Certaines de ces différences peuvent inclure,
Goût
L-Tyrosine: Les formes L des acides aminés sont considérées comme insipides,
Tyrosine: Les formulaires D ont tendance à avoir un goût sucré.
Par conséquent, la l-tyrosine peut être moins / pas plus douce que la tyrosine.
Abondance
L-Tyrosine: Les formes en L de l'acide aminé, y compris la L-tyrosine, la forme la plus abondante dans la nature. À titre d'exemple, neuf des dix-neuf acides Amino L-Amino couramment trouvés dans les protéines sont dextrorotatoires, et les autres sont lévorotatifs.
Tyrosine: Les formes D des acides aminés observées expérimentalement se sont révélées très rarement.
Les références Meyers, s. (2000). Utilisation de précurseurs de neurotransmetteurs pour le traitement de la dépression. Altern Med Rev., 5(1): 64-71. Salomons, t. W. g. et graig, b. F. (2004). Chimie organique (8eEd). Hoboken: John Wiley et Sons, Inc. Webster, D. et Wildgoose, J. (2010). Revue - Supplémentation de la tyrosine pour la phénylcétonurie. COCHRUE DATABASE SYST REV. 4(8): 1507.

