Différence entre KSP et QSP
Différence clé - KSP contre Qsp
KSP est le produit de solubilité constant et QSP est le quotient de produit de solubilité. Le différence clé Entre KSP et QSP est que KSP indique la solubilité d'une substance tandis que QSP indique l'état actuel d'une solution. Le produit de solubilité est le produit de concentrations d'espèces ioniques présentes dans une solution lorsqu'une substance est dissoute dans un solvant comme l'eau.
Le produit de solubilité est déterminé lorsque la solution est saturée de cette substance. Le quotient du produit de solubilité est le produit de concentrations d'espèces ioniques dans une solution à tout moment; Avant la saturation ou après la solution saturée. Il est parfois connu comme le produit ionique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que KSP
3. Qu'est-ce que QSP
4. Relation entre KSP et QSP
5. Comparaison côte à côte - KSP vs QSP sous forme tabulaire
6. Résumé
Qu'est-ce que KSP?
KSP est le produit de solubilité constant d'une substance particulière. Il indique la solubilité d'une substance (quelle quantité de solide est dissoute dans une solution). La constante du produit de solubilité est donnée pour une solution saturée d'une substance. Le KSP est élevé, la solubilité de cette substance est élevée. Le produit de solubilité est donné comme le produit de concentrations d'espèces ioniques dans une solution.
Une solution saturée apparaît avec la nébulosité qui indique le début de la formation d'un précipité. C'est la forme insoluble de soluté. La partie liquide de ce système a les solutés solubles. Le KSP de cette solution représente l'équilibre entre ces formes solubles et insolubles.
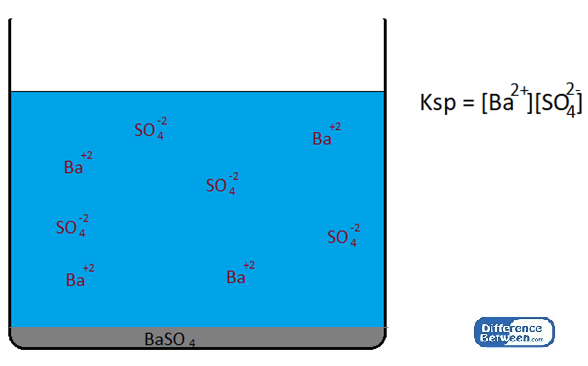
Les facteurs affectant la valeur de la constante du produit de solubilité sont la température, la présence d'ions communs, de pH ou d'acidité, etc. Lorsque la température augmente, la solubilité du précipité solide augmente également. Ensuite, le produit de concentrations d'espèces ioniques augmente, résultant en une valeur élevée de produit de solubilité constante. La présence d'un ion commun est décrite par l'effet d'ion commun. Lorsqu'un ion commun est présent, le KSP est diminué. Un ion commun signifie l'une des espèces ioniques qui sont déjà présentes dans cette solution. Par exemple, pour un système d'équilibre contenant Baso4 (sulfate de baryum) précipité avec, ba+2 ions et donc42- ions, l'ajout de l'un ou l'autre ba+2 environ42- Les ions peuvent affecter l'équilibre.
Baso4 (s)↔ BA+2(aq) + DONC42-(aq)

Figure 01: KSP d'une solution saturée Baso4
Lorsque l'un de ces ions est ajouté à partir d'une source externe, alors l'équilibre ci-dessus se déplace vers le côté gauche (une forme plus insoluble de la substance est formée en diminuant la quantité d'ions présents dans la solution), diminuant la solubilité de cette substance.
Qu'est-ce que QSP?
QSP est le quotient de produit de solubilité d'une solution. Il décrit l'état actuel d'une solution. Cela signifie que QSP est donné pour une solution insaturée (avant saturation), saturée ou sursaturée. Le QSP est également appelé produit ionique car il est le produit de concentrations d'espèces ioniques à tout moment (pas à un moment spécifique comme la saturation). Par conséquent, KSP (le produit de solubilité constant) est une forme spéciale de QSP.
Quelle est la relation entre KSP et QSP?
- Si la valeur QSP est inférieure au KSP pour une substance dans une solution, plus de solides peuvent être dissous dans cette solution.
- Lorsque le QSP et le KSP ont des valeurs égales, alors la solution est devenue saturée.
- Si le QSP est supérieur à la valeur de KSP, un précipité est formé.
Quelle est la différence entre KSP et QSP?
Ksp vs qsp | |
| KSP est le produit de solubilité constant d'une substance particulière. | QSP est le quotient de produit de solubilité d'une solution. |
| Nature | |
| KSP est une valeur d'équilibre. | QSP n'est pas une valeur d'équilibre. |
| État de la solution | |
| KSP est le produit de concentrations d'espèces ioniques dans une solution saturée. | QSP est le produit de concentrations d'espèces ioniques dans une solution insaturée, saturée ou sursaturée. |
Résumé - Ksp contre Qsp
KSP et QSP sont des termes très liés en chimie. Le KSP est défini comme une solution saturée qui a l'équilibre entre les espèces ioniques et un précipité solide (le moment où la formation d'un précipité a commencé). QSP est donné pour tout moment (non spécifié); avant la saturation ou après la saturation. La différence entre KSP et QSP est que KSP est le produit de solubilité constant tandis que QSP est le quotient de produit de solubilité.


