Différence entre le carbonyle et le cétone
Le différence clé entre le carbonyle et le cétone est que Tous les groupes carbonyle ont un atome de carbone avec un atome d'oxygène double lié tandis que les cétones ont un groupe carbonyle attaché à deux groupes alkyle.
Le groupe carbonyle est un groupe fonctionnel commun en chimie organique avec un large éventail de réactivité. Les deux types de carbonyles que nous connaissons sont la cétone et les aldéhydes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le carbonyle
3. Qu'est-ce que le cétone
4. Comparaison côte à côte - carbonyle vs cétone sous forme tabulaire
5. Résumé
Qu'est-ce que le carbonyle?
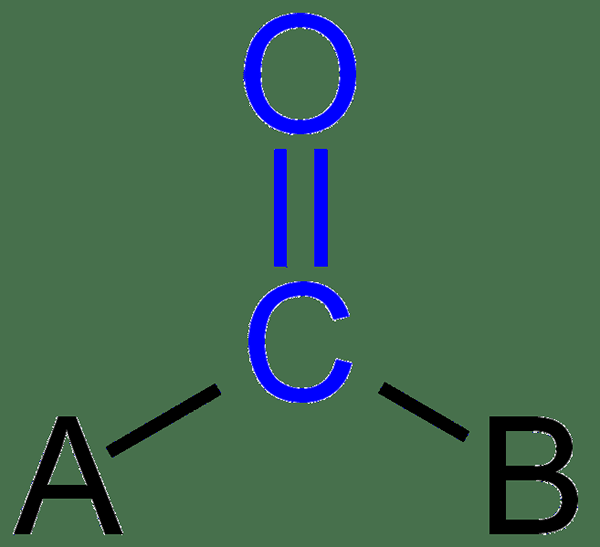
Le groupe carbonyle est un groupe fonctionnel avec de l'oxygène à double liaison à un carbone. Les aldéhydes et les cétones sont des molécules organiques avec ce groupe. Le groupe carbonyle dans un aldéhyde obtient toujours le numéro un dans la nomenclature, car il se produit à la fin de la chaîne de carbone. Cependant, le groupe carbonyle d'une cétone se situe toujours au milieu.
Nature
Selon le type du composé carbonyle, la nomenclature diffère. «Al» est le suffixe que nous utilisons pour nommer des aldéhydes alors que «un» est le suffixe pour les cétones. De plus, l'atome de carbone à côté du carbone carbonyle est le carbone α, qui a une réactivité importante en raison du carbonyle adjacent.
De plus, l'atome de carbone dans le groupe carbonyle est SP2 hybridé. Par conséquent, les aldéhydes et les cétones ont un arrangement plan trigonal autour de l'atome de carbonyle carboné. C'est un groupe polaire (l'électronégativité de l'oxygène est plus grande que le carbone; par conséquent, le groupe carbonyle a un grand moment dipolaire); Ainsi, les aldéhydes et les cétones ont des points d'ébullition plus élevés par rapport aux hydrocarbures ayant le même poids.
Cependant, ceux-ci ne peuvent pas créer des liaisons hydrogène plus fortes comme les alcools qui entraînent des points d'ébullition plus bas que les alcools correspondants. De plus, en raison de la capacité de formation de liaisons hydrogène, les aldéhydes et les cétones à faible poids moléculaire sont solubles dans l'eau. Cependant, lorsque le poids moléculaire augmente, ils deviennent hydrophobes. En dehors de cela, l'atome de carbonyle en carbonyle a une charge positive partielle; Par conséquent, il peut agir comme un électrophile. Par conséquent, ces molécules subissent facilement des réactions de substitution nucléophile.

Figure 01: Structure du groupe carbonyle
Les hydrogènes attachés au carbone; À côté du groupe carbonyle, il a une nature acide, qui explique diverses réactions d'aldéhydes et de cétones. Les composés contenant des groupes carbonyle se produisent largement dans la nature. La cannamaldéhyde (dans l'écorce de cannelle), la vanilline (dans la gousse de vanille), le camphre (camphre) et la cortisone (hormones surrénaliques) sont quelques-uns des composés naturels avec un groupe carbonyle.
Qu'est-ce que le cétone?
En Ketones, le groupe carbonyle est situé entre deux atomes de carbone. La formule générale d'une cétone est la suivante;
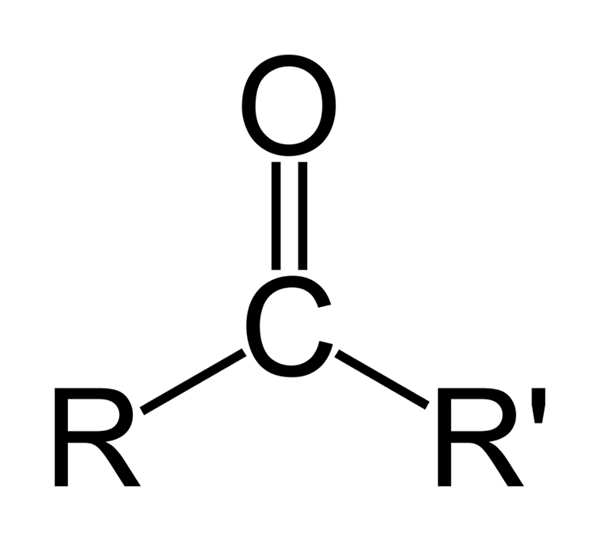
Figure 02: Structure de la cétone
«Un» est le suffixe utilisé dans la nomenclature de la cétone. Au lieu de -e de l'alcane correspondant, nous utilisons «un». De plus, nous pouvons numéroter la chaîne aliphatique d'une manière qui donne au carbone carbonyle le numéro le plus bas possible. Par exemple, nous nommons le composé ch3Coch2Ch2Ch3 Comme 2-pentanone.
De plus, nous pouvons synthétiser les cétones de l'oxydation des alcools secondaires, par ozonolyse des alcènes, etc. Les cétones ont la capacité de subir un tautomérisme kéto-énol. Et, ce processus se produit lorsqu'une base forte occupe le α-hydrogène (hydrogène attaché au carbone, qui est à côté du groupe carbonyle). La capacité de libérer l'α-hydrogène rend les cétones plus acides que les alcanes correspondants.
Quelle est la différence entre le carbonyle et la cétone?
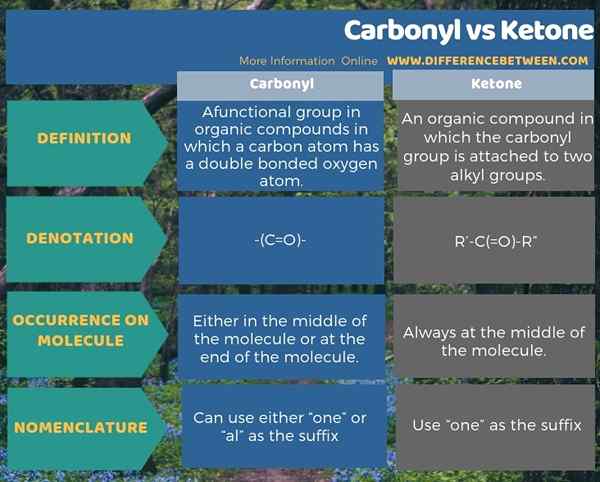
Le groupe carbonyle est un groupe fonctionnel dans des composés organiques dans lesquels un atome de carbone a un atome d'oxygène à double liaison, mais une cétone est un composé organique dans lequel le groupe carbonyle est attaché à deux groupes alkyle. Par conséquent, la principale différence entre le carbonyle et la cétone est que tous les groupes de carbonyle ont un atome de carbone avec un atome d'oxygène à double liaison tandis que les cétones ont un groupe carbonyle attaché à deux groupes alkyle. Nous pouvons désigner un groupe carbonyle as- (c = o) - tandis qu'une cétone comme r'-c (= o) -r ».
De plus, le groupe carbonyle dans une cétone est toujours situé au milieu d'une chaîne tandis que le groupe carbonyle dans un aldéhyde peut être situé aux extrémités d'une molécule. Par conséquent, une autre différence significative entre le carbonyle et la cétone est que le groupe carbonyle peut se produire soit au milieu de la molécule, soit à la fin de la molécule tandis que le groupe carbonyle d'une cétone se produit toujours au milieu de la molécule.
L'infographie ci-dessous sur la différence entre le carbonyle et la cétone fournit plus d'informations sur ces différences.
Résumé - Carbonyle vs Ketone
Les cétones sont un exemple de molécules organiques avec un groupe fonctionnel carbonyle. La principale différence entre le carbonyle et la cétone est que tous les groupes de carbonyle ont un atome de carbone avec un atome d'oxygène à double liaison tandis que les cétones ont un groupe carbonyle attaché à deux groupes alkyle.
Référence:
1. LibreTexts. «Le groupe carbonyle.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
2. Brown, William H. «Cétone.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 27 juin 2018. Disponible ici
Image gracieuseté:
1.”Group carbonyle V.2 "par Jü - Propre travaux, (domaine public) via Commons Wikimedia
2.«Ketone-général» sans auteur lisible par machine fourni. (Domaine public) via Commons Wikimedia


