Différence entre les isomères et la résonance

Isomères vs résonance | Structures de résonance vs isomères | Isomères constitutionnels, stéréoisomères, énantiomères, diastéréomères
Une molécule ou un ion ayant la même formule moléculaire peut exister de différentes manières en fonction des ordres de liaison, des différences de distribution de charge, la façon dont ils s'organisent dans l'espace, etc.
Isomères
Les isomères sont des composés différents avec la même formule moléculaire. Il existe différents types d'isomères. Les isomères peuvent être principalement divisés en deux groupes en tant qu'isomères constitutionnels et stéréoisomères. Les isomères constitutionnels sont des isomères où la connectivité des atomes diffère en molécules. Le butane est l'alcane le plus simple pour montrer l'isomérisme constitutionnel. Butane a deux isomères constitutionnels, le butane lui-même et l'isobutène.
Ch3Ch2Ch2Ch3 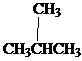
Butane isobutane / 2-méthylpropane
Dans les stéréoisomères, les atomes sont connectés dans la même séquence, contrairement aux isomères constitutionnels. Les stéréoisomères ne diffèrent que par la disposition de leurs atomes dans l'espace. Les stéréoisomères peuvent être de deux types, énantiomères et diastéréomères. Les diastéréomères sont des stéréoisomères dont les molécules ne sont pas des images miroir les unes des autres. Les isomères trans de CIS de 1, 2-dichloroéthène sont des diastéréomères. Les énantiomères sont des stéréoisomères dont les molécules sont des images miroir non superposables les unes des autres. Les énantiomères ne se produisent qu'avec des molécules chirales. Une molécule chirale est définie comme celle qui n'est pas identique à son image miroir. Par conséquent, la molécule chirale et son image miroir sont des énantiomères les uns des autres. Par exemple, la molécule de 2-butanol est chirale, et elle et ses images miroir sont des énantiomères.
Résonance
Lors de l'écriture de structures Lewis, nous ne montrons que des électrons de valence. En faisant part de la part des atomes ou en transférant des électrons, nous essayons de donner à chaque atome la configuration électronique de gaz noble. Cependant, lors de cette tentative, nous pouvons imposer un emplacement artificiel aux électrons. En conséquence, plus d'une structure de Lewis équivalente peut être écrite pour de nombreuses molécules et ions. Les structures écrites en modifiant la position des électrons sont appelées structures de résonance. Ce sont des structures qui n'existent qu'en théorie. La structure de résonance indique deux faits sur les structures de résonance.
- Aucune des structures de résonance ne sera la bonne représentation de la molécule réelle; Personne ne ressemblera complètement aux propriétés chimiques et physiques de la molécule réelle.
- La molécule réelle ou l'ion sera mieux représentée par un hybride de toutes les structures de résonance.
Les structures de résonance sont représentées avec la flèche ↔. Voici les structures de résonance de l'ion carbonate (CO32-).
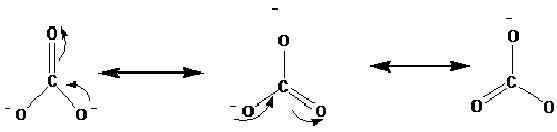
Des études sur les rayons X ont montré que la molécule réelle se situe entre ces résonances. Selon les études, toutes les liaisons en carbone-oxygène sont en longueur égale dans l'ion carbonate. Cependant, selon les structures ci-dessus, nous pouvons voir une double liaison, et deux sont des liaisons simples. Par conséquent, si ces structures de résonance se produisent séparément, idéalement, il devrait y avoir différentes longueurs de liaison dans l'ion. Les mêmes longueurs de liaison n'indiquent qu'aucune de ces structures réellement présente dans la nature, plutôt un hybride de cela n'existe.
| Quelle est la différence entre Isomères et résonance? • Dans les isomères, la disposition atomique ou la disposition spatiale de la molécule peuvent différer. Mais dans les structures de résonance, ces facteurs ne changent pas. Ils n'ont plutôt un changement de position d'un électron. • Les isomères sont naturellement présents, mais les structures de résonance n'existent pas dans la réalité. Ce sont des structures hypothétiques, qui ne sont limitées qu'à la théorie. |


