Différence entre isoélectronique et isosontes
Le différence clé entre isoélectronique et isosontes est que le Les espèces chimiques isoélectroniques ont des configurations électroniques similaires tandis que les Isostes sont des espèces chimiques ayant une taille similaire, le même nombre d'atomes et d'électrons de valence.
Le préfixe «iso-» signifie que deux ou plusieurs espèces chimiques ont la même caractéristique. Les espèces et les isoostéres isoélectroniques sont deux de ces types de caractéristiques. Cependant, ces deux termes sont différents les uns des autres, selon la caractéristique qui est considérée comme comparée entre deux ou plusieurs espèces chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'isoélectronique
3. Qu'est-ce que les Isosteres
4. Comparaison côte à côte - isoélectronique vs isosontes sous forme tabulaire
5. Résumé
Qu'est-ce que l'isoélectronique?
Le terme isoélectronique fait référence à avoir le même nombre d'électrons ou la même configuration électronique. Les espèces chimiques que nous envisageons dans ce contexte comprennent des atomes, des ions ou des molécules. Ces espèces chimiques devraient avoir la même structure électronique du même nombre d'électrons de valence afin de les nommer que les espèces isoélectroniques. En d'autres termes, ce terme fait référence à la fonction «Equal Electric» ou «Equal Charge». En règle générale, ces espèces chimiques présentent également des propriétés chimiques similaires parce que les propriétés chimiques des espèces chimiques sont déterminées par la configuration électronique des espèces chimiques.
Lorsque l'on considère quelques exemples pour les espèces chimiques isoélectroniques, un exemple courant serait l'atome et l'ion li + (cation lithium) où les deux espèces chimiques ont deux électrons dans leurs atomes / ion. De même, K + (cation potassium) et Ca + 2 (cation calcium) sont isoélectroniques car ces deux cations ont la configuration électronique [NE] 4S1. En plus des atomes / ion, nous pouvons également donner quelques exemples pour les molécules qui sont isoélectroniques les unes avec les autres, y compris la molécule de monoxyde de carbone et la molécule d'azote gazeux.
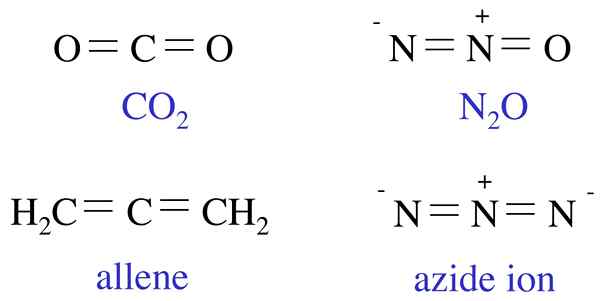
Figure 01: Exemples de molécules isoélectroniques
Le concept de nature isoélectronique des espèces chimiques est utile pour prédire les propriétés et les réactions d'une espèce chimique. Nous pouvons utiliser cette fonctionnalité pour identifier des atomes similaires à l'hydrogène qui a un électron de valence et donc isoélectronique à l'hydrogène. De plus, nous pouvons appliquer ce concept pour identifier des composés inconnus ou rares en fonction de leur ressemblance électronique avec une espèce chimique connue / commune.
Qu'est-ce que les Isosteres?
Le terme Isostere fait référence à des espèces chimiques ayant une taille similaire, le même nombre d'atomes et le même nombre d'électrons de valence. Les espèces chimiques que nous considérons dans ce contexte sont des molécules ou des ions. Par exemple, le benzène et le thiophène sont des molécules isostériques. Généralement, les molécules isostériques ont la même forme en raison de leurs dispositions électroniques identiques. Souvent, ces espèces chimiques ont également des propriétés électroniques similaires. Le concept d'Isosteres a été développé pour la première fois par Irving Langmuir en 1919. Plus tard, il a été modifié par Grimm.
Quelle est la différence entre isoélectronique et isosontes?
La principale différence entre isoélectronique et ISOSTES est que les espèces chimiques isoélectroniques ont des configurations électroniques similaires tandis que les Isostes sont des espèces chimiques ayant une taille similaire, le même nombre d'atomes et d'électrons de valence. De plus, les isoélectroniques décrivent des atomes, des ions ou des molécules tandis que les isosontes décrivent des ions ou des molécules. Par exemple, le monoxyde de carbone et l'azote gaz.
L'infographie suivante résume les différences entre isoélectronique et isosontes sous forme tabulaire pour une comparaison côte à côte.
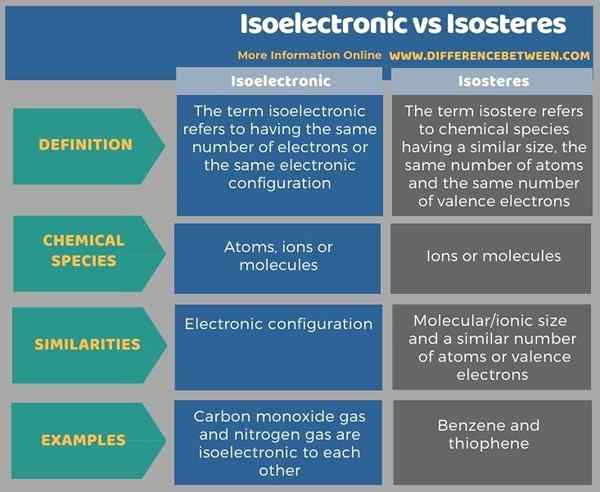
Résumé - isoélectronique vs iSosteres
Le terme isoélectronique est différent du terme isosteres car ils décrivent deux caractéristiques différentes des espèces chimiques. La principale différence entre isoélectronique et Isosteres est que les espèces chimiques isoélectroniques ont des configurations électroniques similaires tandis que les isoosités sont des espèces chimiques ayant une taille similaire, le même nombre d'atomes et d'électrons de valence.
Référence:
1. Helmenstine, Anne Marie. «Définition isoélectronique."Thoughtco, août. 28, 2020, disponible ici.
Image gracieuseté:
1. «Molécules isoélectroniques» par TEM5PSU - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


