Différence entre les composés ioniques et moléculaires
Le différence clé entre les composés ioniques et moléculaires est que le Les composés ioniques ont des forces d'attraction électrostatique entre les cations et les anions tandis que les composés moléculaires n'ont que des liaisons chimiques covalentes entre les atomes.
Les éléments chimiques peuvent se joindre les uns aux autres pour former des composés chimiques. Les éléments se lient ensemble via des liaisons chimiques qui ont des caractéristiques ioniques ou covalentes. Si les composés ont des liaisons ioniques, nous les appelons comme des composés ioniques, et s'ils ont des liaisons covalentes, alors ce sont des composés moléculaires. Par conséquent, la principale différence entre les composés ioniques et moléculaires réside sur la liaison chimique entre les atomes.
CONTENU
1. Aperçu et différence clé
2. Whare sont des composés ioniques
3. Que sont les composés moléculaires
4. Comparaison côte à côte - composés moléculaires ioniques vs sous forme tabulaire
5. Résumé
Quels sont les composés ioniques?
Les composés ioniques sont les composés chimiques qui ont des cations et des anions qui se lient les uns aux autres via une liaison ionique. Par conséquent, il existe des forces d'attraction électrostatique entre cations et anions. Cependant, le composé a une charge neutre globale car la charge totale des cations est neutralisée par la charge totale des anions. Ces ions peuvent être monoatomiques ou polyatomiques.
Habituellement, les composés ioniques contenant l'ion hydrogène (H+) Comme les cations sont des «acides». En revanche, des ions basiques tels que l'ion hydroxyde (oh-) est présent dans les bases. S'il n'y a pas d'ions hydrogène ni d'ions hydroxyde dans le composé ionique, alors nous l'appelons comme un «sel».

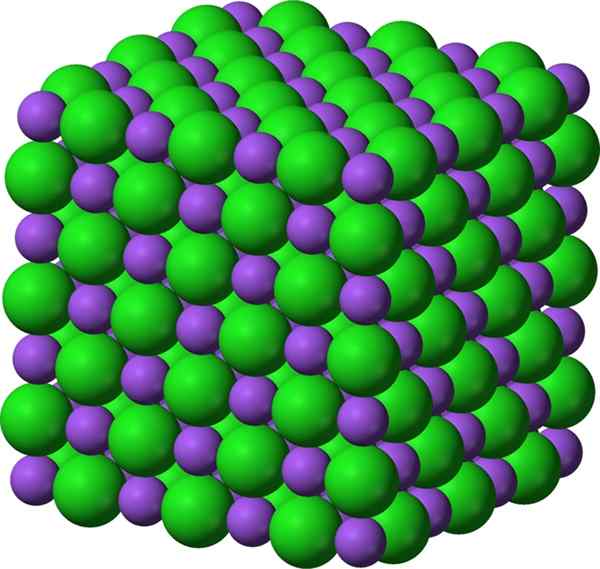
Figure 01: composé ionique du chlorure de sodium, qui est un sel
Certains composés ioniques tels que les sels se forment des réactions de neutralisation acide-base. Certains composés se forment via l'évaporation du solvant, les réactions de précipitation, les réactions à l'état solide, la congélation, les réactions de transfert d'électrons entre les métaux et les non-métaux, etc. En règle générale, ces composés ont des points de fusion et d'ébullition élevés. La plupart du temps, ils sont durs et cassants. Dans leur état solide, presque tous les composés ioniques sont des isolants électriques, et ils peuvent devenir hautement conducteurs lorsqu'ils sont dissous dans un solvant comme l'eau car alors les cations et les anions peuvent se déplacer librement.
Que sont les composés moléculaires?
Les composés moléculaires sont des composés chimiques contenant des atomes liés les uns aux autres via des liaisons chimiques covalentes. Par conséquent, ces composés se forment lorsque les atomes partagent leurs électrons non appariés entre eux. Les atomes impliqués dans ce partage d'électrons ont des valeurs d'électronégativité similaires.
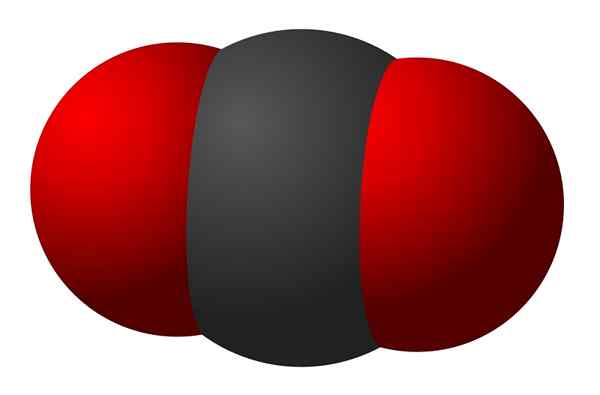
Figure 02: un diagramme d'une molécule triatomique ayant des liaisons covalentes entre les trois atomes
En règle générale, les composés moléculaires ont des points de fusion et d'ébullition relativement faibles parce que les atomes ne sont pas fortement attachés les uns aux autres. De même, ces composés sont doux et relativement flexibles. Par rapport aux composés ioniques, ces composés moléculaires sont très inflammables. En effet, presque toutes les substances inflammables sont des composés moléculaires constitués d'atomes de carbone et d'hydrogène. Contrairement aux composés ioniques, ils ne peuvent pas conduire de l'électricité lorsqu'ils sont dissous dans un solvant car il n'y a pas d'ions disponibles pour se séparer après la dissolution.
Quelle est la différence entre les composés ioniques et moléculaires?
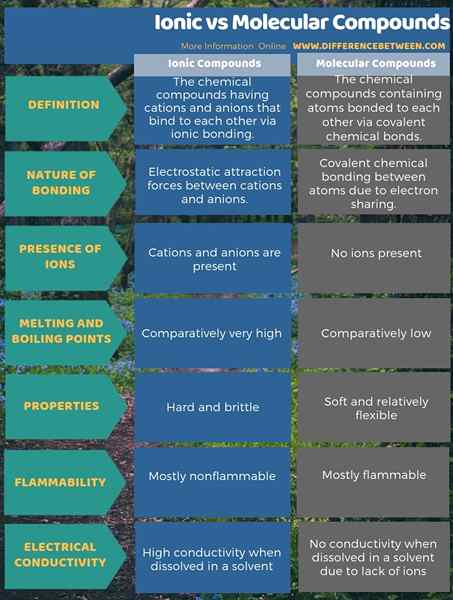
Les composés ioniques sont les composés chimiques qui ont des cations et des anions qui se lient les uns aux autres via une liaison ionique tandis que les composés moléculaires sont des composés chimiques contenant des atomes liés les uns aux autres via des liaisons chimiques covalentes. Par conséquent, la différence entre les composés ioniques et moléculaires réside sur la nature de la liaison chimique. C'est-à-dire; La principale différence entre les composés ioniques et moléculaires est que les composés ioniques ont des forces d'attraction électrostatique entre les cations et les anions tandis que les composés moléculaires n'ont que des liaisons chimiques covalentes entre les atomes.
Comme autre différence importante entre les composés ioniques et moléculaires, les composés ioniques sont durs et cassants tandis que les composés moléculaires sont doux et relativement flexibles. Cela est principalement dû au fait que les atomes des composés ioniques sont maintenus ensemble par des liaisons ioniques alors que dans les composés moléculaires, les atomes se fixent relativement librement. De plus, les points de fusion et d'ébullition des composés ioniques sont très élevés par rapport à celui des composés moléculaires.
Résumé - composés ioniques vs moléculaires
Les composés ioniques ont des liaisons ioniques tandis que les composés moléculaires ont des liaisons covalentes. Par conséquent, la principale différence entre les composés ioniques et moléculaires est que les composés ioniques ont des forces d'attraction électrostatique entre les cations et les anions tandis que les composés moléculaires n'ont que des liaisons chimiques covalentes entre les atomes.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Propriétés des composés covalents ou moléculaires.”Thoughtco, Jun. 7, 2018. Disponible ici
2. «Composé ionique.»Wikipedia, Wikimedia Foundation, 20 octobre. 2018. Disponible ici
Image gracieuseté:
1.«Sodium-chlorure-3d-ionic» par Benjah-Bmm27 - propre travail, (domaine public) via Commons Wikimedia
2.«Carbon-dioxyde-3d-vdw» par Jacek FH - propre travail (CC BY-SA 3.0) via Commons Wikimedia


