Différence entre les composés ioniques et covalents
Différence clé - composés ioniques vs covalents
De nombreuses différences peuvent être notées entre les composés ioniques et covalents en fonction de leurs propriétés macroscopiques telles que la solubilité dans l'eau, la conductivité électrique, les points de fusion et les points d'ébullition. La principale raison de ces différences est la différence dans leur modèle de liaison. Par conséquent, leur modèle de liaison peut être considéré comme le différence clé entre composés ioniques et covalents. (Différence entre les liaisons ioniques et covalentes) Lorsque les liaisons ioniques se forment, les électrons sont donnés par un métal et un électron donné (s) est accepté par un non-métal. Ils forment une forte liaison en raison de l'attraction électrostatique. Des liaisons covalentes se forment entre deux non-métaux. En liaison covalente, deux atomes ou plus partagent des électrons pour satisfaire la règle des octets. Généralement, les liaisons ioniques sont plus fortes que les liaisons covalentes. Cela conduit aux différences dans leurs propriétés physiques.
Quels sont les composés ioniques?
Les liaisons ioniques se forment lorsque deux atomes ont une grande différence dans leurs valeurs d'électronégativité. Dans le processus de formation des liaisons, les pertes d'atomes moins électronégatives électroniques et l'atome plus électronégatif gagnent ces électrons (s). Par conséquent, les espèces qui en résultent sont des ions à charge opposée et ils forment une liaison en raison de la forte attraction électrostatique.
Les liaisons ioniques se forment entre les métaux et les non-métaux. En général, les métaux n'ont pas beaucoup d'électrons de valence dans la coque la plus externe; Cependant, les non-métaux sont plus proches de huit électrons dans la coque de valence. Par conséquent, les non-métaux ont tendance à accepter les électrons pour satisfaire la règle des octets.
Exemple de composé ionique est na+ + CL- à nacl
Le sodium (métal) n'a qu'un seul électron de valence et le chlore (non-métal) a sept électrons de valence. 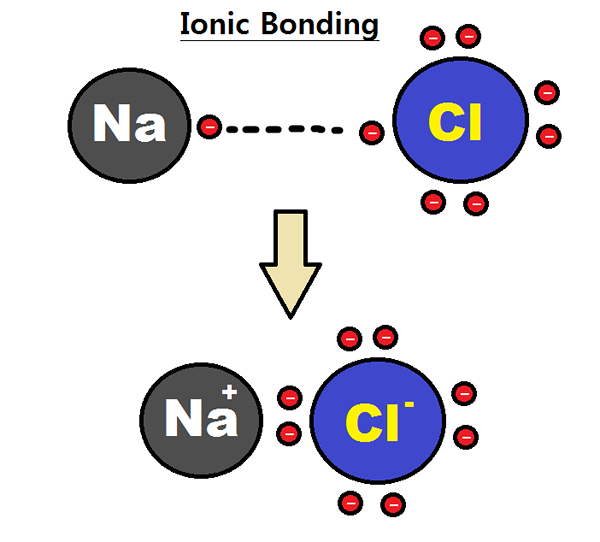
Quels sont les composés covalents?
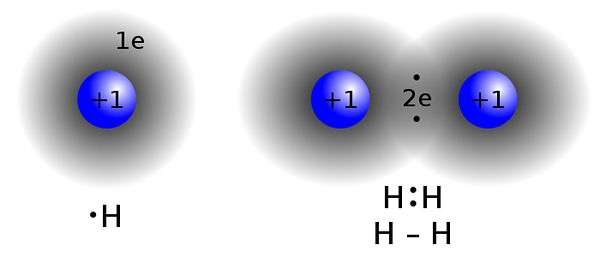
Les composés covalents sont formés en partageant des électrons entre deux atomes ou plus pour satisfaire la «règle des octets». Ce type de liaison se trouve couramment dans les composés non métalliques, les atomes du même composé ou des éléments voisins du tableau périodique.Deux atomes ayant presque les mêmes valeurs d'électronégativité n'échangent pas (donnez / reçoivent) les électrons de leur coquille de valence. Au lieu de cela, ils partagent des électrons pour obtenir la configuration des octets.
Exemples de composés covalents sont du méthane (ch4), Monoxyde de carbone (CO), monobromide d'iode (IBR)

Liaison covalente
Quelle est la différence entre les composés ioniques et covalents?
Définition des composés ioniques et des composés covalents
Composé ionique: Le composé ionique est un composé chimique des cations et des anions qui sont maintenus ensemble par des liaisons ioniques dans une structure de réseau.
Composé covalent: Le composé covalent est une liaison chimique formée par le partage d'un ou plusieurs électrons, en particulier des paires d'électrons, entre les atomes.
Propriétés des composés ioniques et covalents
Propriétés physiques
Composés ioniques:
Tous les composés ioniques existent sous forme de solides à température ambiante.
Les composés ioniques ont une structure cristalline stable. Par conséquent, ils ont des points de fusion plus élevés et des points d'ébullition. Les forces d'attraction entre les ions positives et négatives sont très fortes.
| Composé ionique | Apparence | Point de fusion |
| NaCl - chlorure de sodium | Blanc cristallin blanc | 801 ° C |
| KCL - chlorure de potassium | Cristal vitré blanc ou incolore | 770 ° C |
| MGCL2- Chlorure de magnesium | Solide cristallin blanc ou incolore | 1412 ° C |
Composés covalents:
Les composés covalents existent sous les trois formes; comme solides, liquides et gaz à température ambiante.
Leurs points de fusion et d'ébullition sont relativement faibles par rapport aux composés ioniques.
| Composé covalent | Apparence | Point de fusion |
| Chlorure d'hydrogène HCL | Un gaz incolore | -114.2 ° C |
| Ch4 -Méthane | Un gaz incolore | -182 ° C |
| CCL4 - Le tétrachlorure de carbone | Un liquide incolore | -23 ° C |
Conductivité
Composés ioniques: Les composés ioniques solides n'ont pas d'électrons libres; Par conséquent, ils ne conduisent pas d'électricité sous une forme solide. Mais, lorsque les composés ioniques sont dissous dans l'eau, ils fabriquent une solution qui entraîne l'électricité. En d'autres termes, les solutions aqueuses de composés ioniques sont de bons conducteurs électriques.
Composés covalents: Ni les composés covalents purs ni les formes dissous dans l'eau ne conduisent pas d'électricité. Par conséquent, les composés covalents sont de mauvais conducteurs électriques dans toutes les phases.
Solubilité
Composés ioniques: La plupart des composés ioniques sont solubles dans l'eau, mais ils sont insolubles dans des solvants non polaires.
Composés covalents: La plupart des composés covalents sont solubles dans des solvants non polaires, mais pas dans l'eau.
Dureté
Composés ioniques: Les solides ioniques sont des composés plus durs et cassants.
Composés covalents: Généralement, les composés covalents sont plus doux que les solides ioniques.
Image gracieuseté: «Hydrogène de liaison covalente» par Jacek FH - Propre travaux. (CC BY-SA 3.0) via les communes «ionicbondingrh11» par Rhannosh - propre travail. (CC BY-SA 3.0) via Wikimedia Commons

