Différence entre l'iode et l'iodure de potassium

Le différence clé entre l'iode et l'iodure de potassium est que L'iode est un élément chimique tandis que l'iodure de potassium est un composé chimique.
L'iode est un halogène qui se trouve dans le groupe 17 du tableau périodique des éléments. D'un autre côté, l'iodure de potassium est un composé chimique qui se forme à partir de la combinaison d'iode et de potassium. En conséquence, l'iodure de potassium est très utile dans de nombreuses industries comme source d'iode.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'iode
3. Qu'est-ce que l'iodure de potassium
4. Comparaison côte à côte - iode vs iodure de potassium sous forme tabulaire
5. Résumé
Qu'est-ce que l'iode?
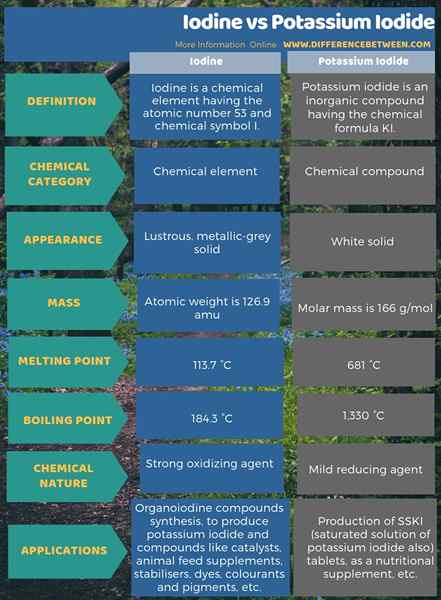
L'iode est un élément chimique ayant le numéro atomique 53 et le symbole chimique I. C'est l'halogène le plus lourd parmi les autres halogènes. Les halogènes sont des éléments chimiques du groupe 17 dans le tableau périodique. De plus, l'iode existe comme un solide brillant et gris métallique à température ambiante. Cependant, il peut facilement subir une sublimation pour former le gaz violet de l'iode. De plus, parmi l'oxydation indique que l'iode peut exister, l'oxydation -1 est la plus courante parmi elles, ce qui se traduit par l'anion iodure. C'est parce que l'iode a un octet incomplet dans sa configuration d'électrons dans laquelle il nécessite un électron pour compléter l'octet. Ensuite, lorsqu'il obtient un électron de l'extérieur, il forme l'état d'oxydation -1.
Certains faits importants sur l'iode sont les suivants:
- Numéro atomique - 53
- Poids atomique standard - 126.9
- Apparence - Solide brillant métallique
- Configuration d'électrons - [KR] 4ddix 5s2 5p5
- Groupe - 17
- Période - 5
- Catégorie chimique - Non-métal
- Le point de fusion est 113.7 ° C
- Le point d'ébullition est 184.3 ° C

Figure 01: Un échantillon d'iode solide
De plus, l'iode est un fort oxydant. Principalement, il est dû à son octet incomplet de la configuration d'électrons dans laquelle il manque un électron pour remplir l'orbital p le plus extérieur. Ainsi, il cherche un électron en oxydant d'autres espèces chimiques. Cependant, c'est l'agent oxydant le plus faible parmi les autres halogènes en raison de sa grande taille atomique.
Qu'est-ce que l'iodure de potassium?
L'iodure de potassium est un composé inorganique et apparaît comme un solide blanc et est produit commercialement en grande quantité. C'est le composé d'iodure le plus important car il est moins hygroscopique que tout autre composé d'iodure. La formule chimique de ce composé est Ki.
Certains faits chimiques importants sur ce composé sont les suivants:
- Formule chimique - Ki
- Masse molaire - 166 g / mol.
- Le point de fusion est de 681 ° C.
- Le point d'ébullition est de 1 330 ° C.
- Il a la structure cristalline du chlorure de sodium.
- Un agent réducteur léger.
- La production est industriellement en traitant KOH avec de l'iode.

Figure 02: Un échantillon d'iodure de potassium massif
L'application la plus importante de Ki est sous forme de comprimés SSKI (solution saturée d'iodure de potassium). Ces comprimés sont pris dans le traitement d'urgence de plusieurs maladies. De plus, SSKI est utile pour le traitement en cas d'exposition aux accidents nucléaires. De plus, Ki est un supplément pour une carence en iode lorsqu'il est ajouté au sel de table. De plus, nous pouvons l'utiliser dans l'industrie de la photographie et dans le domaine de la recherche biomédicale.
Quelle est la différence entre l'iode et l'iodure de potassium?
L'iode est un élément chimique ayant le numéro atomique 53 et le symbole chimique I tandis que l'iodure de potassium est un composé inorganique et apparaît comme un solide blanc et est produit commercialement en grande quantité. Par conséquent, la principale différence entre l'iode et l'iodure de potassium est que l'iode est un élément chimique tandis que l'iodure de potassium est un composé chimique. En bref, l'iode se combine avec le potassium (e.g., Koh) pour produire un composé d'iodure de potassium. En tant qu'une autre différence importante entre l'iode et l'iodure de potassium, nous pouvons dire que l'iode a une apparence brillante et gris métallique tandis que l'iodure de potassium apparaît comme un composé solide blanc.
De plus, il y a une différence entre l'iode et l'iodure de potassium dans leur utilisation également. De plus, il existe également peu de différences dans leurs propriétés chimiques. L'infographie ci-dessous résume la différence entre l'iode et l'iodure de potassium sous forme tabulaire.
Résumé - iode vs iodure de potassium
L'iode étant un halogène ne peut pas rester en tant qu'élément sous température et pression standard mais se combine avec d'autres éléments pour former facilement les composés. Par conséquent, c'est cette propriété pour former des composés qui en font un élément très important. Par conséquent, la principale différence entre l'iode et l'iodure de potassium est que l'iode est un élément chimique tandis que l'iodure de potassium est un composé chimique. L'iode se combine avec du potassium pour former de l'iodure de potassium qui est un composé très important qui est commercialement utile dans diverses industries. Cependant, les isotopes d'iode sont dangereux pour les humains, mais lorsque cet iode est pris sous la forme de Ki, il devient utile aux humains. De plus, une carence en iode entraîne un retard mental et un goitre, cette carence est atteinte par l'administration d'iode sous forme de Ki.
Référence:
1."Iode.»Wikipedia, Wikimedia Foundation, 20 octobre. 2018. Disponible ici
2."Iodure de potassium.»Wikipedia, Wikimedia Foundation, 26 septembre. 2018. Disponible ici
Image gracieuseté:
1.«Échantillon d'iode» par Lhchem - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Iodure de potassium» (domaine public) via Commons Wikimedia


