Différence entre imide et amide
Différence clé - imide vs amide
Les imides et les amides sont des composés organiques contenant des atomes C, H, N et O. Ces deux composés contiennent des groupes d'acyle attachés à un atome d'azote. La principale différence entre imide et amide est que l'imide est Un composé organique composé de deux groupes d'acyle liés au même atome d'azote tandis que l'amide est un composé organique composé d'un groupe acyle lié à un atome d'azote.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'imide
3. Qu'est-ce que l'amide
4. Comparaison côte à côte - imide vs amide sous forme tabulaire
5. Résumé
Qu'est-ce que l'imide?
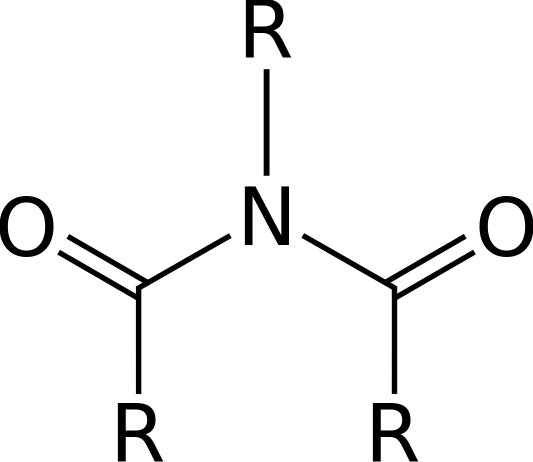
Un imide est un composé organique qui se compose de deux groupes acyle liés au même atome d'azote. La structure d'un imide ressemble aux anhydrides acides. Ces composés sont très polaires et sont bien dissous dans les solvants polaires.

Figure 1: Structure générale d'un imide
La préparation des imides se fait en chauffant les acides dicarboxyliques avec de l'ammoniac (ou des amines primaires). Le type de réaction chimique impliquée dans cette préparation est une réaction de condensation entre l'acide dicarboxylique et l'amine qui donne un imide.
Les imides formés à partir d'ammoniac contient une liaison N-H entre deux groupes acyle. Cette liaison N-H donne la possibilité de former des liaisons hydrogène. Ce centre N-H est acide. Cela conduit à la formation de sels métalliques alcalins d'Imides; par exemple, phtalimide de potassium. Les atomes d'azote dans les imides ne sont pas aussi basiques. Cela permet aux imides de former des dérivés de n-halo par la réaction entre un imide et un halogène en présence d'une base.
Qu'est-ce que l'amide?
Un amide est un composé organique qui se compose d'un groupe acyle lié à un atome d'azote. Il est également appelé un amide acide. Parfois, ce terme est utilisé pour nommer la base conjuguée de l'ammoniac (le NH2- anion). Les amides les plus simples sont dérivés de l'ammoniac où un atome d'hydrogène de l'ammoniac est remplacé par un groupe acyle. Les amides complexes sont formés à partir d'amines primaires et secondaires. Les amides primaires sont formés à partir d'ammoniac tandis que les amides secondaires sont formés à partir d'amines primaires, et les amides tertiaires sont formés à partir d'amines secondaires. Les amines tertiaires ne peuvent pas participer à la formation d'amides.
Lorsque vous envisagez la structure réelle d'un amide, il existe une double liaison partielle entre l'azote et l'atome de carbone du groupe acyle en raison de la délocalisation de la paire solitaire sur l'atome d'azote. Cela signifie que les amides ont des structures de résonance qui déterminent la structure réelle de l'amide.
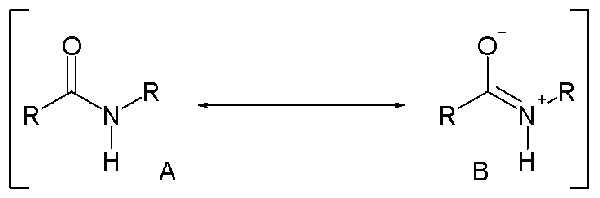
Figure 2: Structures de résonance d'un amide
Il existe plusieurs méthodes pour la synthèse d'un amide. La méthode la plus élémentaire est la réaction entre l'acide carboxylique et une amine. Cette réaction nécessite une énergie thermique élevée car l'énergie d'activation de la réaction est très élevée.
Quelle est la différence entre imide et amide?
Imide vs amide | |
| Un imide est un composé organique qui se compose de deux groupes acyle liés au même atome d'azote. | Un amide est un composé organique qui se compose d'un groupe acyle lié à un atome d'azote. |
| Groupe acyle | |
| Un imide a au moins deux groupes d'acyle. | Un amide a au moins un groupe acyle. |
| Valeur des matériaux diamagnétiques | |
| Un imide peut être préparé en chauffant les acides dicarboxyliques avec de l'ammoniac ou des amines primaires. | Un amide peut être préparé par la réaction entre l'acide carboxylique et l'ammoniac en présence d'une température élevée. |
Résumé - imide vs amide
Les imides et les amides sont des composés organiques contenant de l'azote. La principale différence entre l'imide et l'amide est que l'imide est un composé organique composé de deux groupes d'acyle liés au même atome d'azote tandis que l'amide est un composé organique composé d'un groupe acyle lié à un atome d'azote.
Référence:
1. «Imide.»Wikipedia, Wikimedia Foundation, 3 avril. 2018, disponible ici.
2. «Amides.”Chemistry LibreTexts, 11 mars. 2017, disponible ici.
Image gracieuseté:
1. «Amideresonance» de V8rik à la langue anglaise Wikipedia (CC By-SA 3.0) via Commons Wikimedia
2. «Imide Functional Group» par CJP24 - Propre travaux (domaine public) via Commons Wikimedia