Différence entre l'hydroxyle et l'hydroxyde
Différence clé - hydroxyle vs hydroxyde
Les deux termes hydroxyle et hydroxyde sont très similaires car les deux ont deux atomes similaires, l'oxygène (O = 16) et l'hydrogène (h = 1). L'hydroxyde est un ion négatif avec une seule charge et l'hydroxyle ne se trouve pas dans sa forme libre, il fait partie d'une autre molécule ou ion. Les ions hydroxyde sont plus réactifs que le groupe hydroxyle dans une molécule. C'est la principale différence entre l'hydroxyle et l'hydroxyde.
Qu'est-ce que l'hydroxyle?
L'hydroxyle est un composé neutre et c'est le composé électriquement neutre correspondant de l'ion hydroxyde. La forme libre d'hydroxyle (• ho) est un radical et lorsqu'elle est liée de manière covalente à d'autres molécules, elle est désignée comme le groupe hydroxyle (-OH). Les groupes hydroxyles peuvent agir comme des nucléophiles et le radical hydroxyle est utilisé comme catalyseur en chimie organique. Les groupes hydroxyles ne sont pas très réactifs comme les autres nucléophiles. Cependant, ce sont les facilitateurs de la formation de fortes forces intramoléculaires appelées «liaisons hydrogène».
Qu'est-ce que l'hydroxyde?
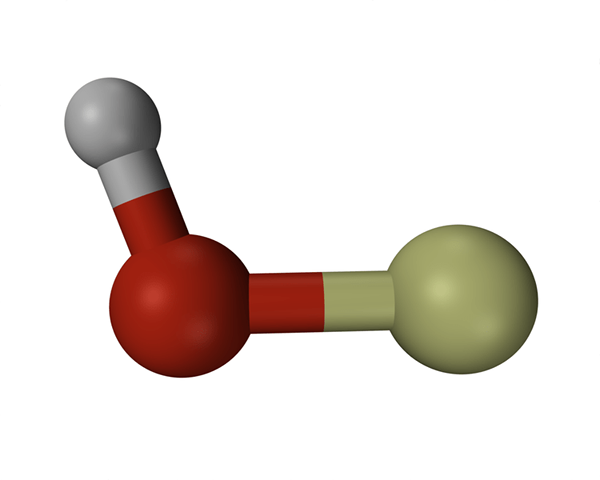
L'hydroxyde est un anion diatomique qui contient un atome d'oxygène et un atome d'hydrogène. La liaison entre l'oxygène et l'atome d'hydrogène est covalente et sa formule chimique est oh-. L'auto-ionisation de l'eau produit des ions hydroxyles et donc les ions hydroxyle sont un élément naturel de l'eau. Les ions d'hydroxyde sont utilisés comme base, un ligand, un nucléophile et un catalyseur dans les réactions chimiques. De plus, les ions hydrogène produisent des sels avec des cations métalliques et la plupart d'entre eux se dissocient dans des solutions aqueuses, libérant des ions hydroxyde solvatés. De nombreuses substances chimiques inorganiques contiennent le terme «hydroxyde» en leur nom, mais ils ne sont pas ioniques et ce sont des composés covalents qui contiennent des groupes hydroxyles.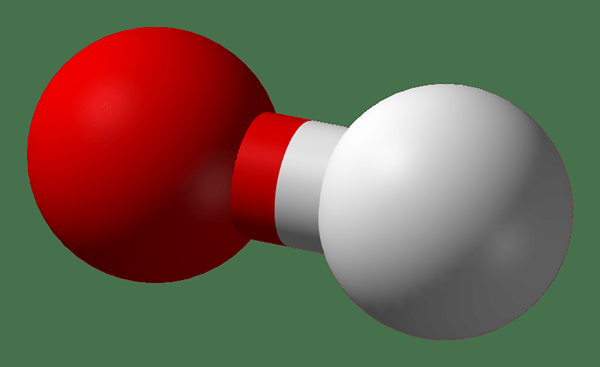
Quelle est la différence entre l'hydroxyle et l'hydroxyde?
Structure:
Hydroxyle: Hydroxyl est un composé électriquement neutre qui peut être trouvé de deux manières, comme la forme radicale et liée de manière covalente.

Radical hydroxyle lorsqu'il est lié de manière covalente à une molécule
Hydroxyde: L'hydroxyde est un ion chargé négativement et la charge négative est sur l'atome d'oxygène.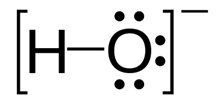 Propriétés:
Propriétés:
Hydroxyle: Des groupes hydroxyles se trouvent dans de nombreux composés organiques; alcools, acides carboxyliques et groupes hydroxyles contenant du sucre. Les composés contenant des groupes hydroxyles tels que l'eau, les alcools et les acides carboxyliques peuvent être facilement déprotonés. De plus, ces groupes hydroxyles sont engagés dans la formation de liaisons hydrogène. Les liaisons hydrogène aident les molécules à rester ensemble et cela conduit à la possession de points d'ébullition et de fusion plus élevés. En général, les composés organiques sont mal solubles dans l'eau; Ces molécules deviennent légèrement solubles lorsqu'ils contiennent deux groupes hydroxyles ou plus.
Hydroxyde:La plupart des produits chimiques contenant de l'hydroxyde sont considérés comme très corrosifs, et certains sont très nocifs.Lorsque ces produits chimiques sont dissous dans l'eau, l'ion hydroxyde agit comme une base incroyablement forte. Étant donné que l'ion hydroxyde porte une charge négative, il est souvent lié à des ions chargés positivement.
Certains composés ioniques contenant des groupes d'hydroxyde dans leur molécule se dissolvent très bien dans l'eau; Des bases corrosives telles que l'hydroxyde de sodium (NaOH) et l'hydroxyde de potassium (KOH) peuvent être prises comme exemples. Cependant, certains autres composés ioniques contenant de l'hydroxyde sont légèrement insolubles dans l'eau; Les exemples sont l'hydroxyde de cuivre (II) [Cu (OH)2 - Couleurs bleu vif] et en fer (ii) hydroxyde [Fe (OH)2- brun].
Réactivité:
Hydroxyle: Les groupes hydroxyles sont moins réactifs par rapport au groupe d'hydroxyde. Mais, les groupes hydroxyles forment facilement les liaisons hydrogène et contribuent à rendre les molécules plus solubles dans l'eau.
Cependant, les radicaux hydroxyles sont très réactifs et très utiles dans les réactions chimiques organiques.
Hydroxyde: Hydroxyde (oh-) Le groupe est considéré comme un nucléophile fort en chimie organique.
Références: [Protégé par e-mail], m. C. (n.d.). Ions hydroxyde. Récupéré le 28 décembre 2016, d'ici Hydroxyde Ion: Définition et formule - Transcription vidéo et leçon. (n.d.). Récupéré le 28 décembre 2016, à partir d'ici hydroxyde. (n.d.). Récupéré le 28 décembre 2016, d'ici le groupe Hydroxy. (n.d.). Récupéré le 28 décembre 2016, d'ici Hydroxyl Group: Définition, structure et formule. (n.d.). Récupéré le 28 décembre 2016, d'ici h. (2014). Qu'est-ce qu'un groupe hydroxyle? Récupéré le 28 décembre 2016, d'ici

