Différence entre le fluorure d'hydrogène et l'acide hydrofluorique

Le différence clé entre le fluorure d'hydrogène et l'acide hydrofluorique Le fluorure d'hydrogène est un composé inorganique tandis que l'acide hydrofluorique est une solution de fluorure d'hydrogène dans l'eau.
Le fluorure d'hydrogène et l'acide hydrofluorique ont la même formule chimique, HF, qui contient un atome d'hydrogène et un atome de fluor. Cependant, ce sont deux termes différents en fonction des propriétés chimiques et physiques. Par conséquent, ici, nous discuterons de ces différences entre le fluor à l'hydrogène et l'acide hydrofluorique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le fluor à l'hydrogène
3. Qu'est-ce que l'acide hydrofluorique
4. Comparaison côte à côte - fluorure d'hydrogène vs acide hydrofluorique sous forme tabulaire
5. Résumé
Qu'est-ce que le fluor à l'hydrogène?
Le fluorure d'hydrogène est un composé chimique ayant la formule chimique HF. Il a un atome d'hydrogène et un atome de fluor lié les uns aux autres via une liaison covalente. C'est une molécule diatomique, mais sous sa forme solide, il y a des chaînes Zig-Zag HF. Ces chaînes HF sont créées en raison des fortes liaisons hydrogène qui se forment entre les molécules HF. La forme liquide contient également cette structure. Certains faits chimiques sur ce composé sont les suivants:
- La masse molaire est de 20 g / mol
- Il se produit comme un gaz incolore; L'état liquide est également incolore
- Le point de fusion est -83.6 ° C tandis que le point d'ébullition est 19.5 ° C
- En raison de la capacité de HF à former des liaisons hydrogène, ce composé est complètement miscible avec l'eau

Nous pouvons produire ce composé par la réaction entre l'acide sulfurique et les grades purs du minéral «fluorite». Cependant, la plupart des HF sont produits comme sous-produit de la production d'engrais. Il existe plusieurs utilisations importantes de HF; comme précurseur des composés organofluorins, comme précurseur des fluorures métalliques, comme catalyseur, comme solvant, etc.
Qu'est-ce que l'acide hydrofluorique?
L'acide hydrofluorique est une solution aqueuse de HF. Cela signifie que c'est une solution de fluorure d'hydrogène dans l'eau. Nous pouvons écrire la formule chimique comme HF(aq). Il apparaît comme une solution incolore. De plus, cette solution est miscible avec l'eau. Le nom IUPC pour cette solution est Fluorane. La solution est un acide faible en raison de la force de la liaison H-F et de la formation de grappes de HF, H2O et f-.

De plus, nous pouvons produire cet acide faible en traitant la fluorite minérale avec de l'acide sulfurique. Il existe une large gamme d'utilisations pour l'acide hydrofluorique. Les applications comprennent le lien de raffinage d'huile, la production de composés organofluoriques, la production de fluorures, en tant qu'agent de nettoyage, etc.
Quelle est la différence entre le fluorure d'hydrogène et l'acide hydrofluorique?
En comparant les propriétés du fluorure d'hydrogène et de l'acide hydrofluorique, la principale différence entre le fluorure d'hydrogène et l'acide hydrofluorique est que le fluorure d'hydrogène est un composé inorganique tandis que l'acide hydrofluorique est une solution de fluorure d'hydrogène dans l'eau. Par conséquent, le fluorure d'hydrogène se compose d'atomes H et F, tandis que l'acide hydrofluorique contient des molécules HF dans l'eau.
L'infographie ci-dessous fournit plus de détails sur la différence entre le fluorure d'hydrogène et l'acide hydrofluorique.
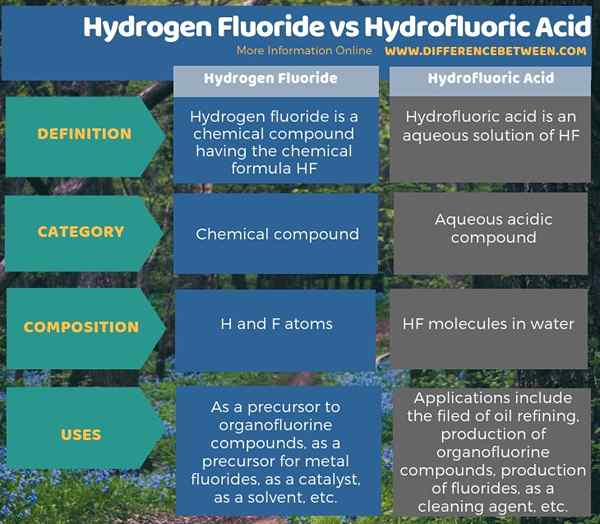
Résumé - fluorure d'hydrogène vs acide hydrofluorique
En résumé, le fluorure d'hydrogène et l'acide hydrofluorique sont deux formes différentes du même composé. Surtout, la principale différence entre le fluorure d'hydrogène et l'acide hydrofluorique est que le fluorure d'hydrogène est un composé inorganique tandis que l'acide hydrofluorique est une solution de fluorure d'hydrogène dans l'eau.
Référence:
1. O'Neill, Tomás B., et al. «Burnes chimiques complexes après un incident de plante chimique de masse de victimes: comment la planification et l'organisation optimales peuvent faire la différence.”Burns, Vol. 38, non. 5, 2012, pp. 713-718., doi: 10.1016 / J.brûlures.2011.12.010.
Image gracieuseté:
1. Le «fluorure d'hydrogène» par le téléchargeur d'origine était el t à EN.wikipedia - transféré de en.Wikipedia (domaine public) via Commons Wikimedia
2. «Fluorure d'hydrogène» par l'utilisateur: Dorgan - autochotographié (CC By-SA 3.0) via Commons Wikimedia


