Différence entre l'hydratation et l'hydrogénation
Le différence clé entre l'hydratation et l'hydrogénation est que L'hydratation fait référence à l'ajout de molécules d'eau à un composé organique, tandis que l'hydrogénation se réfère à l'ajout d'une molécule d'hydrogène à un composé organique.
L'hydratation et l'hydrogénation sont importantes dans les réactions de synthèse chimique. Ces deux réactions impliquent l'ouverture d'une double liaison dans un composé organique par addition d'un substituant aux atomes de carbone dans la double liaison. Les substituants ajoutés dans ces processus sont différents les uns des autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'hydratation
3. Qu'est-ce que l'hydrogénation
4. Comparaison côte à côte - hydratation vs hydrogénation sous forme tabulaire
5. Résumé
Qu'est-ce que l'hydratation?
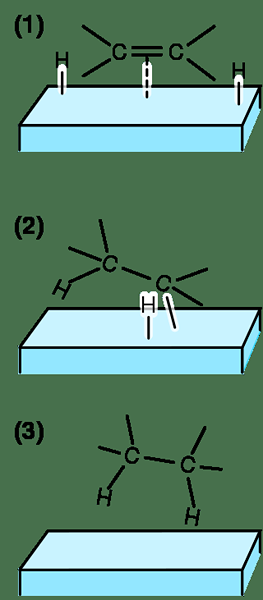
L'hydratation est l'ajout d'une molécule d'eau à un composé organique. Le composé organique est généralement un alcène, qui a une double liaison entre deux atomes de carbone. La molécule d'eau est ajoutée à cette double liaison sous la forme d'un groupe hydroxyle (OH-) et un proton (h+). Par conséquent, la molécule d'eau se dissocie dans ses ions avant cet ajout. Le groupe hydroxyle est attaché à un atome de carbone de la double liaison tandis que le proton est attaché à l'autre atome de carbone.
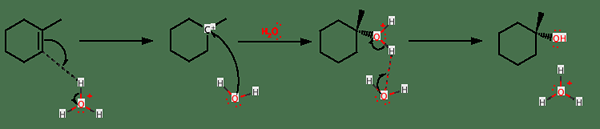
Figure 01: Une réaction d'hydratation simple
Puisqu'il implique la rupture des liaisons et la formation de liaisons, la réaction est très exothermique. Cela signifie; La réaction libère l'énergie sous forme de chaleur. Il s'agit d'une réaction pas à pas; Dans la première étape, l'alcène agit comme un nucléophile et attaque le proton de la molécule d'eau et se lie avec lui à travers l'atome de carbone moins substitué. Ici, la réaction suit la règle de Markonikov.
La deuxième étape comprend la fixation de l'atome d'oxygène de la molécule d'eau à l'autre atome de carbone (atome de carbone hautement substitué) de la double liaison. À ce stade, l'atome d'oxygène de la molécule d'eau porte une charge positive car elle porte trois liaisons uniques. Vient ensuite une autre molécule d'eau qui prend le proton supplémentaire de la molécule d'eau attachée, laissant le groupe hydroxyle à l'atome de carbone moins substitué. Ainsi, cette réaction conduit à la formation d'un alcool. Cependant, les alcynes (triple liaison contenant des hydrocarbures) peuvent également subir une réaction d'hydratation.
Qu'est-ce que l'hydrogénation?
L'hydrogénation est le processus d'addition d'une molécule d'hydrogène à un composé organique. De plus, cette réaction implique le traitement d'un composé organique avec de l'hydrogène gazeux. Habituellement, la réaction se produit en présence d'un catalyseur tel que le nickel, le palladium ou le platine. Les hydrogénations non catalytiques ne sont possibles qu'à des températures très élevées. De plus, ce processus est important dans la réduction des composés organiques insaturés. Cela signifie; L'hydrogénation peut ouvrir des liaisons doubles ou des liaisons triples dans des composés organiques et les transformer en composés contenant des liaisons uniques.
Le processus d'hydrogénation a trois composants: substrat insaturé, source d'hydrogène et catalyseur. Les conditions de réaction telles que la température et la pression varient en fonction du type de composé insaturé et du catalyseur. Le substrat peut être un alcène ou un alcyne. L'hydrogénation peut avoir lieu de deux manières: catalyse homogène et catalyse hétérogène.
Dans la catalyse homogène, le métal catalyseur se lie à la fois avec l'alcène et l'hydrogène pour donner un produit intermédiaire (complexe intermédiaire intermédiaire de l'alcène-catalyseur)). Puis le transfert d'un atome d'hydrogène du métal au carbone dans la double liaison (ou triple liaison) se produit. Ce qui se passe ensuite, c'est le transfert de l'autre atome d'hydrogène de la source d'hydrogène au groupe alkyle avec une dissociation simultanée de l'alcane.

Figure 02: Trois étapes de l'hydrogénation
Dans la catalyse hétérogène, la liaison insaturée se lie avec le catalyseur tandis que la source d'hydrogène subit une dissociation en deux atomes d'hydrogène. Ensuite, une étape réversible se produit où un atome d'hydrogène se lie à la liaison insaturée. Enfin, une réaction irréversible se produit où l'autre atome d'hydrogène se fixe au groupe alkyle.
Quelle est la différence entre l'hydratation et l'hydrogénation?
L'hydratation et l'hydrogénation sont des processus importants dans la synthèse chimique. La principale différence entre l'hydratation et l'hydrogénation est que l'hydratation se réfère à l'ajout de molécules d'eau à un composé organique, tandis que l'hydrogénation se réfère à l'ajout d'une molécule d'hydrogène à un composé organique.
En dessous de l'infographie résume la différence entre l'hydratation et l'hydrogénation.
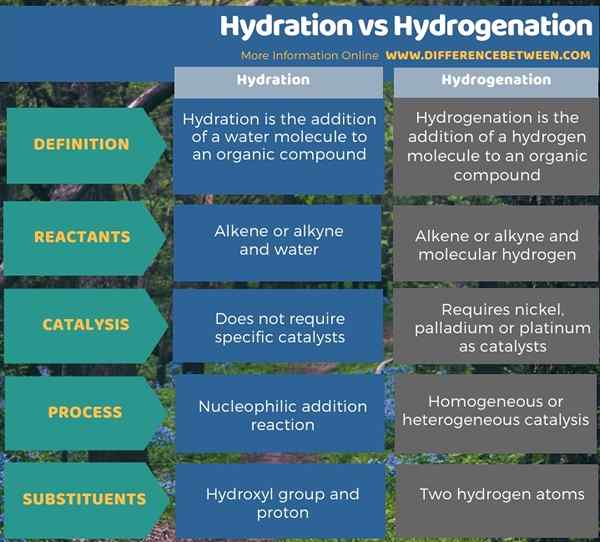
Résumé - Hydratation vs hydrogénation
L'hydratation et l'hydrogénation sont des processus importants dans la synthèse chimique. La principale différence entre l'hydratation et l'hydrogénation est que l'hydratation se réfère à l'ajout de molécules d'eau à un composé organique, tandis que l'hydrogénation se réfère à l'ajout d'une molécule d'hydrogène à un composé organique.
Référence:
1. «Spécification pour les électrodes sélectives en ions, les électrodes de référence, les électrodes combinées et les compteurs d'électrode sélective en ions pour la détermination des ions en solution.»Doi: 10.3403 / 00222406U.
Image gracieuseté:
1. «HydratationReAction» par CCROBERTS - PROPRE WORK (DOMAIN PUBLIC) via Commons Wikimedia
2. «Hydrogénation on Catalyst» de Michael Schmid - Dessin Created Myself (CC By-SA 4.0) via Commons Wikimedia


