Différence entre l'énergie de dissociation des liaisons homolytique et hétérolytique
Différence clé - Énergie de dissociation des liaisons homolytiques vs hétérolytiques
L'énergie de dissociation des liaisons est une mesure de la résistance d'une liaison chimique. Une liaison peut être dissociée de manière homolytique ou de manière hétérolytique. L'énergie de dissociation des liaisons est définie comme le changement d'enthalpie standard lorsqu'une liaison chimique est clivée par homolyse. L'énergie de dissociation des liaisons homolytiques est la quantité d'énergie nécessaire pour dissocier une liaison chimique via l'hémolyse tandis que l'énergie de dissociation des liaisons hétérolytiques est la quantité d'énergie nécessaire pour graver une liaison chimique via l'hétérolyse. La valeur de l'énergie de dissociation des liaisons homolytiques est différente de celle de l'énergie de dissociation des liaisons hétérolytiques pour le même composé. C'est la principale différence entre l'énergie de dissociation des liaisons homolytique et hétérolytique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'énergie de dissociation des liaisons homolytiques
3. Qu'est-ce que l'énergie de dissociation des liaisons hétérolytiques
4. Comparaison côte à côte - Énergie de dissociation de liaison hétérolytique vs hétérolytique dans la forme tabulaire
5. Résumé
Qu'est-ce que l'énergie de dissociation des liaisons homolytiques?
L'énergie de dissociation de liaison homolytique est la quantité d'énergie nécessaire pour dissocier une liaison chimique via l'hémolyse. L'hémolyse d'une liaison chimique est le clivage symétrique de la liaison formant deux radicaux, pas deux ions. Ici, les électrons de liaison entre les atomes sont divisés en deux moitiés et sont pris par les deux atomes. Par exemple, le clivage homolytique d'une liaison Sigma forme deux radicaux ayant un électron non apparié pour chaque radical.

Figure 1: Homolyse
L'énergie de dissociation des liaisons est définie comme la quantité d'énergie nécessaire pour cliver une liaison chimique par hémolyse dans des conditions standard. L'énergie de dissociation de liaison homolytique détermine si une liaison chimique est forte ou faible. Si la valeur de l'énergie de dissociation des liaisons homolytiques est plus élevée, elle indique qu'une quantité élevée d'énergie doit être fournie afin de cliver cette liaison; Par conséquent, c'est un lien fort.
Qu'est-ce que l'énergie de dissociation des liaisons hétérolytiques?
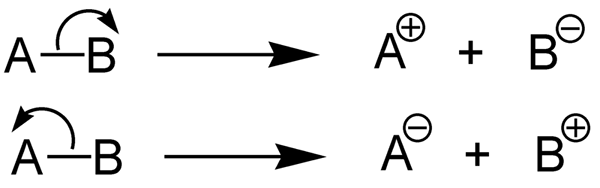
L'énergie de dissociation des liaisons hétérolytiques est la quantité d'énergie nécessaire pour applaudir une liaison chimique via l'hétérolyse. L'hétérolyse est le clivage d'une liaison chimique de manière asymétrique. L'hétérolyse forme des cations et des anions. En effet, en hétérolyse, la paire d'électrons de liaison est prise par l'atome électronégatif (il est converti en anion) tandis que l'autre atome ne prend pas d'électrons (il forme le cation)).

Figure 2: Hétérolyse des liaisons chimiques
Par rapport à l'homolyse d'une molécule, l'hétérolyse de la même molécule est une valeur différente de celle de l'homolyse. Cela signifie que l'énergie de dissociation de liaison homolytique d'un composé est différente de l'énergie de dissociation de liaison hétérolytique de la même molécule.
Ex: Considérons le clivage de la liaison H-H dans la molécule d'hydrogène.
Dissociation de liaison homolytique: H2 → H ● + H ● (L'énergie de dissociation des liaisons est de 104 kcal / mol)
Dissociation de liaison hétérolytique: H2 → H+ + H- (L'énergie de dissociation des liaisons est de 66 kcal / mol)
Quelle est la différence entre l'énergie de dissociation des liaisons homolytique et hétérolytique?
Énergie de dissociation des liaisons homolytiques vs hétérolytiques | |
| L'énergie de dissociation de liaison homolytique est la quantité d'énergie nécessaire pour dissocier une liaison chimique via l'hémolyse. | L'énergie de dissociation des liaisons hétérolytiques est la quantité d'énergie nécessaire pour applaudir une liaison chimique via l'hétérolyse. |
| Produit | |
| L'énergie de dissociation des liaisons homolytiques est associée à la formation de radicaux par le clivage des liaisons chimiques. | L'énergie de dissociation des liaisons hétérolytiques est associée à la formation de cations et d'anions par le clivage des liaisons chimiques. |
Résumé - Énergie de dissociation des liaisons homolytiques vs hétérolytiques
L'énergie de dissociation des liaisons est l'énergie nécessaire pour cliver une liaison chimique via l'homolyse dans des conditions standard. Il existe deux types de clivages de liaisons comme homolyse et hétérolyse. Le clivage des liaisons homolytiques forme des radicaux tandis que le clivage des liaisons hétérolytiques forme des cations et des anions. La principale différence entre l'énergie de dissociation des liaisons homolytique et hétérolytique est que la valeur de l'énergie de dissociation des liaisons homolytiques est différente de celle de l'énergie de dissociation des liaisons hétérolytiques pour le même composé.
Référence:
1. «Énergie de dissociation des liaisons.»Wikipedia, Wikimedia Foundation, 28 février. 2018, disponible ici.
2. «Hétérolyse (chimie).»Wikipedia, Wikimedia Foundation, 19 février. 2018, disponible ici.
3. «Énergies de dissociation des liaisons = clivage homolytique.»Master Organic Chemistry RSS, disponible ici.
Image gracieuseté:
1. «Homolyse (chimie)» par Jürgen Martens - Jürgen Martens (domaine public) via Commons Wikimedia
2. «Hétérolyse (chimie)» par [Jürgen Martens - Jürgen Martens (CC BY-SA 3.0) via Commons Wikimedia


