Différence entre l'holoenzyme et l'apoenzyme

Différence clé - Holoenzyme vs apoenzyme
Les enzymes sont des catalyseurs biologiques qui augmentent le taux de réactions chimiques dans le corps. Ce sont des protéines composées de séquences d'acides aminés. Les enzymes sont impliquées dans les réactions chimiques sans être consommée. Ils sont spécifiques aux substrats et aux réactions chimiques. La fonction de l'enzyme est soutenue par différentes petites molécules non protéinées. Ils sont connus sous le nom de cofacteurs. Ils aident les enzymes dans leur action catalytique. Ces cofacteurs peuvent être des ions métalliques ou des coenzymes; Ils peuvent également être des molécules inorganiques ou organiques. De nombreuses enzymes nécessitent un cofacteur pour devenir actif et initier la fonction catalytique. Sur la base de la liaison avec le cofacteur, les enzymes ont deux formes nommées apoenzyme et holoenzyme. La principale différence entre l'holoenzyme et l'apoenzyme est que L'apoenzyme est le composant protéique de l'enzyme qui est inactif et non lié au cofacteur alors que L'holoenzyme est le composant protéique de l'enzyme et du cofacteur lié qui crée la forme active de l'enzyme.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'Holoenzyme
3. Qu'est-ce que l'apoenzyme
4. Comparaison côte à côte - Holoenzyme vs apoenzyme sous forme tabulaire
5. Résumé
Qu'est-ce que l'Holoenzyme?
Les enzymes sont des protéines qui catalysent les réactions biochimiques dans les cellules. La plupart des enzymes nécessitent une petite molécule non protéique pour initier les fonctions catalytiques. Ces molécules sont connues sous le nom de cofacteurs. Les cofacteurs sont principalement des molécules inorganiques ou organiques. Les cofacteurs sont classés en deux types principaux nommés ions métalliques et coenzymes. La liaison du cofacteur est essentielle pour l'activation de l'enzyme et l'initiation de la réaction chimique. Lorsque le composant protéique de l'enzyme est lié au cofacteur, la molécule complète est connue sous le nom d'holoenzyme. L'holoenzyme est catalytiquement actif. Par conséquent, il se lie activement aux substrats et augmente la vitesse de la réaction. Les coenzymes se lient librement aux enzymes tandis que les groupes prothétiques se lient étroitement aux apoenzymes. Certains cofacteurs se lient au site actif de l'enzyme. Lors de la liaison, il modifie la conformation de l'enzyme et améliore la liaison des substrats au site actif de l'enzyme.
L'ADN polymérase et l'ARN polymérase sont deux holoenzymes. L'ADN polymérase nécessite que les ions de magnésium deviennent actifs et déclenchent une polymérisation de l'ADN. ARN polymérase a besoin d'un facteur sigma pour sa fonction catalytique.
Qu'est-ce que l'apoenzyme?
L'apoenzyme est l'enzyme avant de se lier avec le cofacteur. En d'autres termes, l'apoenzyme est la partie protéique de l'enzyme qui n'a pas le cofacteur. L'apoenzyme est catalytiquement inactif et incomplet. Il forme un système enzymatique actif lors de la combinaison avec une coenzyme et détermine la spécificité de ce système pour un substrat. Il existe de nombreux cofacteurs qui se lient aux apoenzymes pour fabriquer des holoenzymes. Les coenzymes courants sont le NAD +, la mode, la coenzyme A, les vitamines B et la vitamine C. Les ions métalliques communs qui se lient aux apoenzymes sont le fer, le cuivre, le calcium, le zinc, le magnésium, etc. Les cofacteurs se lient étroitement ou vaguement avec l'apoenzyme pour convertir l'apoenzyme en holoenzyme. Une fois le cofacteur retiré de l'holoenzyme, il est à nouveau converti en apoenzyme, qui est inactif et incomplet.
La présence du cofacteur sur le site actif de l'apoenzyme est essentielle car ils fournissent des groupes ou des sites que la partie protéique de l'enzyme ne possède pas pour catalyser la réaction.
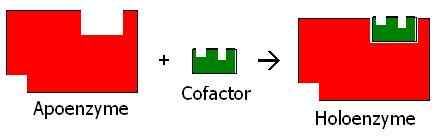
Figure 01: apoenzyme et holoenzyme
Quelle est la différence entre l'holoenzyme et l'apoenzyme?
Holoenzyme vs apoenzyme | |
| L'holoenzyme est une enzyme active composée d'une apoenzyme liée à son cofacteur. | L'apoenzyme est le composant protéique qui n'a pas son cofacteur. |
| Cofacteur | |
| L'holoenzyme est liée à son cofacteur. | L'apoenzyme est la composante enzymatique sans le cofacteur. |
| Activité | |
| L'holoenzyme est catalytiquement actif. | L'apoenzyme est catalytiquement inactif. |
| Complétude | |
| L'holoenzyme est complète et peut initier la réaction. | L'apoenzyme est incomplète et ne peut pas initier la réaction. |
| Exemples | |
| L'ADN polymérase, l'ARN polymérase sont des exemples d'Holoenzym. | L'aspartate transcarbamoylase est un exemple pour l'apoenzyme. |
Résumé - Holoenzyme vs apoenzyme
Les enzymes sont des catalyseurs biologiques des cellules. Ils abaissent l'énergie nécessaire pour l'occurrence de réaction. Les enzymes augmentent le taux de réaction en induisant activement la conversion du substrat en produits. Ils catalysent spécifiquement les réactions sans entrer dans les réactions. Les enzymes sont composées de molécules de protéines. La partie protéique de l'enzyme est connue sous le nom d'apoenzyme. L'apoenzyme a besoin de se lier avec de petites molécules non protéinaces appelées cofacteurs pour devenir actifs. Lorsque l'apoenzyme se lie avec le cofacteur, le complexe est appelé holoenzyme. L'holoenzyme est catalytiquement actif pour initier la réaction chimique. Le substrat se lie à l'holoenzyme, pas avec l'apoenzyme. C'est la différence entre l'holoenzyme et l'apoenzyme.
Télécharger la version PDF de Holoenzyme vs apoenzyme
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon les notes de citation. Veuillez télécharger la version PDF ici différence entre Holoenzyme et Apoenzyme.
Les références:
1.«Biochimie structurelle / enzyme / apoenzyme et holoenzyme.«Biochimie structurelle / enzyme / apoenzyme et holoenzyme - wikiabooks. N.p., n.d. la toile. Disponible ici. 12 juin 2017.
2. BIOCHIMIE. N.p., n.d. la toile. Disponible ici. 13 juin 2017.
Image gracieuseté:
1. «Enzymes» de Moniquepena - Propre travaux (domaine public) via Commons Wikimedia


