Différence entre la chaleur de fusion et la cristallisation
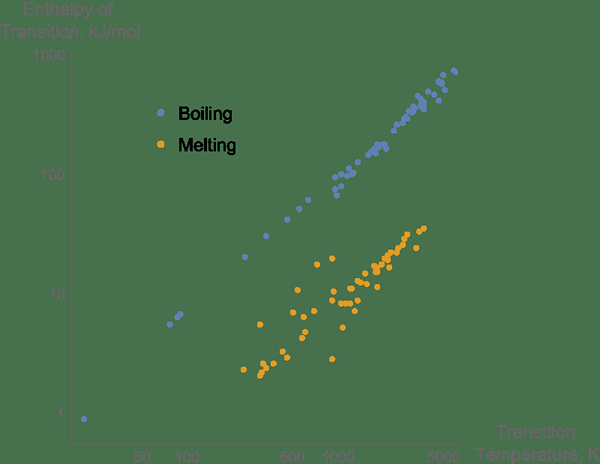
Le différence clé entre la chaleur de fusion et la cristallisation est que La chaleur de fusion se réfère au changement d'énergie lorsqu'un état solide d'une substance particulière se transforme en état liquide tandis que la chaleur de cristallisation se réfère à la chaleur qui est absorbée ou évoluée lorsqu'une taupe de substance donnée subit une cristallisation.
Les réactions chimiques se produisent généralement par absorption ou libération d'énergie. Ici, l'énergie est évoluée ou absorbée principalement sous forme de chaleur. Par conséquent, le changement d'énergie pour une réaction particulière peut être nommé comme la chaleur de cette réaction ou comme l'enthalpie de cette réaction.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la chaleur de fusion
3. Qu'est-ce que la chaleur de cristallisation
4. Comparaison côte à côte - chaleur de fusion vs cristallisation sous forme tabulaire
5. Résumé
Qu'est-ce que la chaleur de fusion?
La chaleur de fusion ou Enthalpie de fusion est l'énergie qui change lors de la conversion de la phase d'une substance de l'état solide à l'état liquide. En règle générale, les changements d'énergie se produisent sous forme de chaleur, et la réaction doit avoir lieu dans une pression constante afin de définir une chaleur appropriée de fusion. La chaleur de solidification est le terme égal et opposé à la chaleur de fusion.
La chaleur de fusion est définie pour la fusion d'une substance. Ce changement d'énergie est nommé comme chaleur latente car la température reste constante pendant le processus de conversion. Si nous considérons le changement d'énergie par quantité de substance en moles, alors le terme pour ce processus peut être donné comme une chaleur molaire de fusion.

Généralement, la phase liquide d'une substance a une énergie interne élevée par rapport à sa phase solide car son énergie cinétique est plus élevée que l'énergie potentielle. Par conséquent, nous devons fournir une certaine énergie à un solide afin de le faire fondre. En revanche, une substance libère de l'énergie lorsqu'un liquide devient solide ou gèle. Ceci est principalement dû aux molécules du liquide dans les interactions intermoléculaires plus faibles que les molécules en phase solide.
Qu'est-ce que la chaleur de cristallisation?
La chaleur de cristallisation ou Enthalpie de cristallisation est l'énergie qui change pendant la cristallisation d'une substance. La cristallisation peut se produire soit comme un processus naturel, soit comme un processus artificiel. Dans la phase solide d'une substance, les molécules ou les atomes sont fortement organisés en une structure cristalline. Nous appelons cela une structure cristalline. Un cristal peut se former de différentes manières telles que les précipitations d'une solution, la congélation, le dépôt directement à partir d'un gaz (rarement), etc.

Il existe deux étapes majeures de cristallisation: la nucléation (une phase cristalline apparaît soit dans un liquide surfoncé ou un solvant sursaturé), et une croissance cristalline (l'augmentation de la taille des particules et conduit à un état cristallin).
Quelle est la différence entre la chaleur de fusion et la cristallisation?
Une réaction chimique se produit via l'absorption ou l'énergie en évolution sous forme de chaleur. La chaleur de fusion et la chaleur de cristallisation sont deux exemples de ce type de réactions. Et, la principale différence entre la chaleur de fusion et de cristallisation est que la chaleur de fusion se réfère au changement d'énergie lorsqu'un état solide d'une substance particulière se transforme en un état liquide tandis que la chaleur de cristallisation se réfère à la chaleur qui est absorbée ou a évolué Quand une taupe d'une substance donnée subit une cristallisation.
Vous trouverez ci-dessous une tabulation sommaire de la différence entre la chaleur de fusion et la cristallisation.

Résumé - chaleur de fusion vs cristallisation
Une réaction chimique se produit via l'absorption ou l'énergie en évolution sous forme de chaleur. La chaleur de fusion et la chaleur de cristallisation sont deux exemples de ce type de réactions. La principale différence entre la chaleur de la fusion et de la cristallisation est que la chaleur de fusion se réfère au changement d'énergie lorsqu'un état solide d'une substance particulière se transforme en état liquide tandis que la chaleur de cristallisation se réfère à la chaleur qui est absorbée ou évoluée lorsqu'elle une mole d'une substance donnée subit une cristallisation.
Référence:
1. "Température de fusion.”Chemistry LibreTexts, LibreTexts, 14 juillet 2020, disponible ici.
Image gracieuseté:
1. «Enthalpies de la fusion et de l'ébullition pour les éléments purs par rapport aux températures de transition» par Mgibby5 (CC BY-SA 3.0) via Commons Wikimedia
2. «Snowflakeswilsonbentley» par Wilson Bentley - Planche XIX de «Studies parmi les cristaux de neige…» par Wilson Bentley, «The Snowflake Man.«Du résumé annuel de la« Revue des météo mensuels »pour 1902 (domaine public) via Commons Wikimedia


