Différence entre le brome et le bromure

Le différence clé entre le brome et le bromure Le bromure est la forme réduite de brome.
Les éléments chimiques du tableau périodique ne sont pas stables à l'exception des gaz nobles. Par conséquent, les éléments essaient de réagir avec d'autres éléments pour gagner la configuration d'électrons à gaz noble pour atteindre la stabilité. De même, le brome doit également obtenir un électron pour atteindre la configuration électronique du noble gaz krypton. Tous les métaux réagissent avec le brome, formant des bromures. Le brome et le bromure ont des propriétés physiques et chimiques différentes en raison du changement d'un électron.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le brome
3. Qu'est-ce que le bromure
4. Comparaison côte à côte - Bromine vs bromure sous forme tabulaire
5. Résumé
Qu'est-ce que le brome?
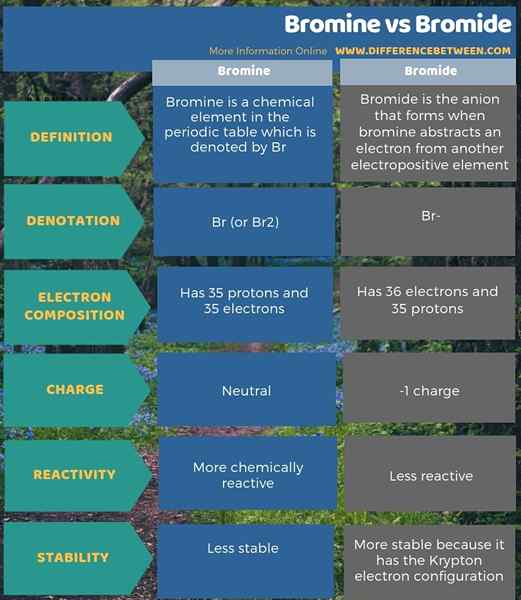
Le brome est un élément chimique dans le tableau périodique qui est indiqué par Br. C'est un halogène (17e groupe) dans le 4e période du tableau périodique. Le nombre atomique de brome est de 35; Ainsi, il a 35 protons et 35 électrons. Sa configuration électronique est [ar] 4s2 3Ddix 4p5. Depuis le p Le sous-niveau doit avoir 6 électrons pour obtenir la configuration d'électrons à gaz Krypton Noble, Bromine a la capacité d'attirer un électron. Il a une électronégativité élevée, qui est environ 2.96, selon l'échelle Pauling.
Le poids atomique du brome est de 79.904 AMU. À température ambiante, il existe comme molécule diatomique (BR2). De plus, cette molécule diatomique est un liquide de couleur brun rouge. Le brome a un point de fusion de 265.8 K et un point d'ébullition de 332.0 k.
Autres propriétés du brome
Parmi tous les isotopes de brome, BR-79 et BR-81 sont les isotopes les plus stables. De plus, cet élément chimique est légèrement soluble dans l'eau mais bien soluble dans les solvants organiques comme le chloroforme. De plus, il a 7, 5, 4, 3, 1, -1 états d'oxydation.
La réactivité chimique du brome se situe entre celle du chlore et de l'iode. Le brome est moins réactif que le chlore mais plus réactif que l'iode. Le brome produit l'ion bromure en prenant un électron. Par conséquent, le brome participe facilement à la formation de composés ioniques. En fait, dans la nature, le brome existe sous forme de sels de bromure au lieu de BR2.

Figure 01: Bromine
Le brome peut oxyder les anions d'éléments situés en dessous du brome dans le tableau périodique. Cependant, il ne peut pas oxyder le chlorure pour donner du chlore. De plus, nous pouvons produire BR en traitant des saumures riches en bromure avec du chlore gazeux. Ou bien le gaz brome est formé en traitant du HBR avec de l'acide sulfurique. Le brome est très utile dans les laboratoires de l'industrie et des produits chimiques. Les composés de bromure sont importants comme additifs à essence, pour les pesticides et comme désinfectant dans la purification de l'eau.
Qu'est-ce que le bromure?
Le bromure est l'anion qui se forme lorsque le brome résume un électron d'un autre élément électropositif. Nous pouvons le représenter par le symbole Br-. C'est un ion monovalent avec -1 charge. Par conséquent, il a 36 électrons et 35 protons.

La configuration électronique du bromure est [ar] 4S2 3Ddix 4p6. Il existe dans des composés ioniques tels que le bromure de sodium, le bromure de calcium et le HBR. Il existe également naturellement dans les sources d'eau.
Quelle est la différence entre le brome et le bromure?
Le brome est un élément chimique dans le tableau périodique qui est indiqué par BR tandis que le bromure est l'anion qui se forme lorsque le brome résume un électron d'un autre élément électropositif. De plus, la principale différence entre le brome et le bromure est que le bromure est la forme réduite de brome. De plus, le bromure compte 36 électrons contre 35 électrons de brome, mais les deux ont 35 protons. Par conséquent, le bromure a une charge -1 tandis que le brome est neutre.
De plus, le brome est plus réactif chimiquement que le bromure. De plus, une autre différence entre le brome et le bromure est que le bromure a atteint la configuration d'électrons Krypton et est donc plus stable que l'atome de brome.
Résumé - Bromine vs bromure
Le brome est un élément chimique dans le tableau périodique et est indiqué par Br. Pendant ce temps, le bromure est l'anion qui se forme lorsque le brome résume un électron d'un autre élément électropositif. De plus, la principale différence entre le brome et le bromure est que le bromure est la forme réduite de brome.
Image gracieuseté:
1. «Bromine 25 ml (transparent)» par w. Oelen - (CC BY-SA 3.0) via Commons Wikimedia
2. «Br-» par Neurotiker - Propre travaux (domaine public) via Commons Wikimedia


