Différence entre la capacité thermique et la chaleur spécifique
Le différence clé entre la capacité thermique et la chaleur spécifique est que La capacité thermique dépend de la quantité de substance, tandis que la capacité thermique spécifique en est indépendante.
Lorsque nous chauffons une substance, sa température augmente et lorsque nous la refroidissons, sa température diminue. Cette différence de température est proportionnelle à la quantité de chaleur fournie. La capacité thermique et la chaleur spécifique sont deux constantes de proportionnalité qui se rapportent au changement de température et à la quantité de chaleur.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la capacité thermique
3. Qu'est-ce que la chaleur spécifique
4. Comparaison côte à côte - Capacité thermique vs chaleur spécifique sous forme tabulaire
5. Résumé
Qu'est-ce que la capacité thermique?
Dans la thermodynamique, l'énergie totale d'un système est l'énergie interne. L'énergie interne spécifie l'énergie cinétique et potentielle totale des molécules dans le système. Nous pouvons changer l'énergie interne d'un système soit en travaillant sur le système ou en le chauffant. L'énergie interne d'une substance augmente lorsque nous augmentons sa température. La quantité d'augmentation dépend des conditions dans lesquelles le chauffage a lieu. Ici, nous avons besoin de chaleur pour augmenter la température.
La capacité thermique (c) d'une substance est «la quantité de chaleur nécessaire pour augmenter la température d'une substance par un degré Celsius (ou un Kelvin).»La capacité thermique diffère de la substance à la substance. La quantité de substance est directement proportionnelle à la capacité thermique. Cela signifie qu'en double la masse d'une substance, la capacité thermique devient doublée. La chaleur dont nous avons besoin pour augmenter la température de t1 à t2 d'une substance peut être calculée en utilisant l'équation suivante.
q = c x ∆t
Q = chaleur requise
∆t = t1-t2

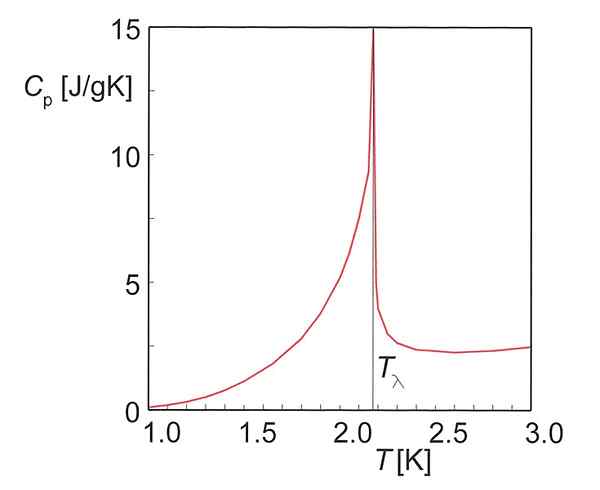
Figure 01: Capacité thermique de l'hélium
L'unité de capacité thermique est JºC-1 ou jk-1. Deux types de capacités de chaleur sont définies dans la thermodynamique; Capacité thermique à une pression constante et à la capacité thermique à un volume constant.
Qu'est-ce que la chaleur spécifique?
La capacité thermique dépend de la quantité de substance. La chaleur spécifique ou la capacité de chaleur spécifique est la capacité thermique qui est indépendante de la quantité de substances. Nous pouvons le définir comme «la quantité de chaleur nécessaire pour augmenter la température d'un gramme d'une substance par un degré Celsius (ou un Kelvin) à une pression constante."
L'unité de chaleur spécifique est jg-1oC-1. La chaleur spécifique de l'eau est très élevée, avec une valeur de 4.186 jg-1oC-1. Cela signifie que pour augmenter la température de 1 g d'eau par 1 ° C, nous avons besoin de 4.186 J d'énergie thermique. Cette valeur élevée explique le rôle de l'eau dans la régulation thermique. Pour trouver la chaleur nécessaire pour augmenter la température d'une certaine masse d'une substance de T1 à T2, l'équation suivante peut être utilisée.
q = m x s x ∆t
Q = chaleur requise
M = masse de la substance
∆t = t1-t2
Cependant, l'équation ci-dessus ne s'applique pas si la réaction implique un changement de phase; Par exemple, lorsque l'eau va à une phase gazeuse (au point d'ébullition) ou lorsque l'eau gèle pour former de la glace (au point de fusion). En effet, la chaleur ajoutée ou supprimée pendant le changement de phase ne change pas la température.
Quelle est la différence entre la capacité thermique et la chaleur spécifique?
La principale différence entre la capacité thermique et la chaleur spécifique est que la capacité thermique dépend de la quantité de substance tandis que la capacité thermique spécifique en est indépendante. De plus, lorsque vous envisagez la théorie, la capacité thermique de la quantité de chaleur nécessaire pour modifier la température d'une substances de 1 ° C ou 1k tandis que la chaleur spécifique est la chaleur nécessaire pour modifier 1 g de température de substances de 1 ° C ou 1K.

Résumé - Capacité thermique vs chaleur spécifique
La capacité thermique et la chaleur spécifique sont des termes importants dans la thermodynamique. La principale différence entre la capacité thermique et la chaleur spécifique est que la capacité thermique dépend de la quantité de substance tandis que la capacité thermique spécifique en est indépendante.
Référence:
1. Helmenstine, Anne Marie. «Capacité thermique spécifique en chimie."Thoughtco, mar. 21, 2019, disponible ici.
Image gracieuseté:
1. «Capacité thermique de 4he 01» par Adwaele à Anglais Wikipedia (CC BY-SA 3.0) via Commons Wikimedia


