Différence entre les éléments du groupe 1 et du groupe 2
Le différence clé entre les éléments du groupe 1 et du groupe 2 Tous les éléments du groupe 1 ont des électrons non appariés dans leur orbite la plus à l'extérieur, tandis que les éléments du groupe 2 ont des électrons jumelés dans leur orbite la plus externe.
Les groupes 1 et 2 du tableau périodique contiennent des éléments de bloc. Cela signifie; Ces éléments ont leurs électrons les plus externes dans l'orbital S. Les groupes 1 et 2 diffèrent les uns des autres en fonction du nombre d'électrons dans leur orbite la plus externe. Une orbitale S ne peut contenir que deux électrons car le nombre quantique magnétique de cette orbitale est 0.
CONTENU
1. Aperçu et différence clé
2. Quels sont les éléments du groupe1
3. Quels sont les éléments du groupe 2
4. Comparaison côte à côte - Groupe1 vs éléments du groupe 2 sous forme tabulaire
5. Résumé
Quels sont les éléments du groupe 1?
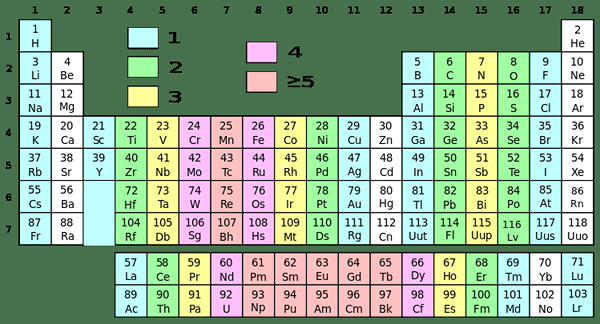
Les éléments du groupe 1 sont des éléments chimiques ayant un électron non apparié dans l'orbitale la plus externe. C'est la première colonne du bloc S du tableau périodique. Il contient des métaux d'hydrogène et alcalins. Les membres de ce groupe 1 sont les suivants:
- Hydrogène (H)
- Lithium (li)
- Sodium (NA)
- Potassium (k)
- Rhubidium (RH)
- Césium (CS)
- Francium (FR)

Figure 01: Tableau périodique avec différents groupes de différentes couleurs
Bien que l'hydrogène soit dans ce groupe en raison de sa configuration d'électrons, il a des caractéristiques distinctes des métaux alcalins. Par exemple, l'hydrogène existe sous forme de gaz, tandis que d'autres éléments de ce groupe sont des métaux. Ces métaux sont tous brillants, hautement réactifs et très doux (nous pouvons facilement les couper en utilisant un couteau simple).
Généralement, les éléments du groupe 1 présentent de faibles densités, de faibles points de fusion, de faibles points d'ébullition et ont des structures cristallines cubiques centrées sur le corps. De plus, ils ont des couleurs de flamme distinctes, nous pouvons donc facilement les distinguer en exposant un échantillon à un brûleur Bunsen. Lorsque vous descendez le groupe de métaux alcalins, il existe des variations périodiques comme indiqué ci-dessous.
- La taille atomique augmente
- Le point de fusion et la diminution du point d'ébullition en raison de la capacité de former des liaisons fortes diminuent dans le groupe (lorsque l'atome devient grand, la liaison formée est faible).
- La densité augmente.
- L'énergie de première ionisation diminue car dans les grands atomes, l'électron le plus externe est lié de manière lâche et peut facilement être retiré.
- Électronégativité
- La réactivité diminue.
- Les métaux alcalins ont de faibles affinités électroniques que les autres éléments.
Quels sont les éléments du groupe 2?
Les éléments du groupe 2 sont des éléments chimiques ayant leur paire d'électrons la plus externe dans une orbite S. Par conséquent, leurs électrons de valence sont sous la forme de NS2. De plus, ce groupe est la deuxième colonne du bloc S. Nous les nommons comme des métaux de la Terre alcalins. Les membres de ce groupe sont les suivants:
- Béryllium (be)
- Magnésium (mg)
- Calcium (CA)
- Strontium (SR)
- Barium (BA)
- Radium (RA)
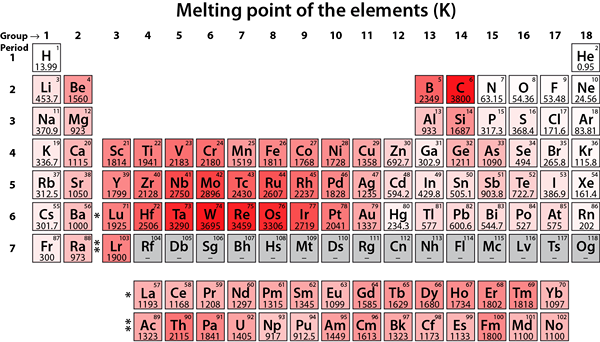
Figure 02: Points de fusion des éléments
Ces éléments métalliques ont tendance à stabiliser leur configuration d'électrons en éliminant deux électrons les plus externes pour obtenir une configuration d'électrons à gaz noble. Par conséquent, ces éléments ont tendance à former +2 cations. Ces métaux sont moins réactifs par rapport aux éléments du groupe 1. De plus, ces éléments ont des points de fusion plus élevés par rapport aux éléments du groupe 1, et leurs hydroxydes sont relativement moins basiques.
Quelle est la différence entre les éléments du groupe 1 et du groupe 2?
Les groupes 1 et 2 diffèrent les uns des autres en fonction du nombre d'électrons dans leur orbite la plus externe. La principale différence entre les éléments du groupe 1 et du groupe 2 est que tous les éléments du groupe 1 ont des électrons non appariés dans leur orbitale la plus externe, tandis que les éléments du groupe 2 ont des électrons jumelés dans leur orbite la plus externe.
L'infographie ci-dessous montre plus de comparaisons concernant la différence entre les éléments du groupe 1 et du groupe 2.
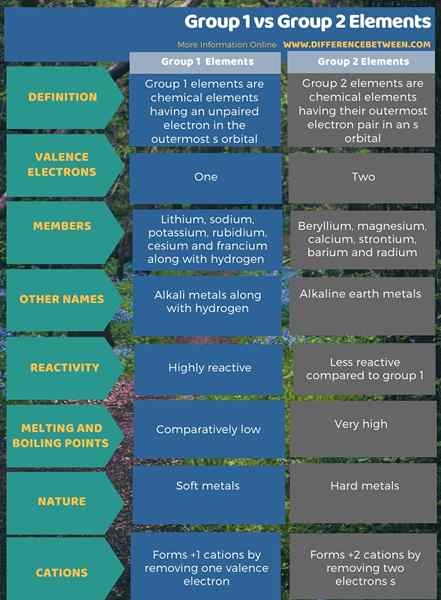
Résumé - Groupe 1 contre les éléments du groupe 2
Les groupes 1 et 2 diffèrent les uns des autres en fonction du nombre d'électrons dans leur orbite la plus externe. La principale différence entre les éléments du groupe 1 et du groupe 2 est que tous les éléments du groupe 1 ont des électrons non appariés dans leur orbitale la plus externe, tandis que les éléments du groupe 2 ont des électrons jumelés dans leur orbite la plus externe.
Référence:
1.«Groupe 1: Hydrogène et métaux alcalins.”Chemistry LibreTexts, LibreTexts, 23 juin 2019, disponible ici.
2. Helmenstine, Anne Marie. «Tableau périodique des groupes d'éléments."Thoughtco, nov. 11, 2019, disponible ici.
Image gracieuseté:
1. «Tableau périodique avec électrons non appariés» par KES47 - Version SVG à partir d'une image JPG créée par SAI2020 le 2009-02-03: Fichier: Table périodique avec E non apparié E-.JPG, (domaine public) via Commons Wikimedia
2. «Point de fusion des éléments (k)» par Albris - propre travail (CC BY-SA 4.0) via Commons Wikimedia


