Différence entre le graphite et le graphène

Le différence clé entre le graphite et le graphène est que Le graphite est un allotrope de carbone ayant un nombre élevé de feuilles de carbone tandis que le graphène est une seule feuille de graphite en carbone.
Le graphite est un allotrope de carbone bien connu. De plus, nous le considérons comme un demi-métal, et il a une structure en couches avec plusieurs couches de carbone qui sont bien emballées les unes sur les autres. Une couche hors de ces couches est une feuille de graphène. Une feuille de graphène est considérée comme une nanoparticule selon ses dimensions.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le graphite
3. Qu'est-ce que le graphène
4. Comparaison côte à côte - graphite vs graphène sous forme tabulaire
5. Résumé
Qu'est-ce que le graphite?
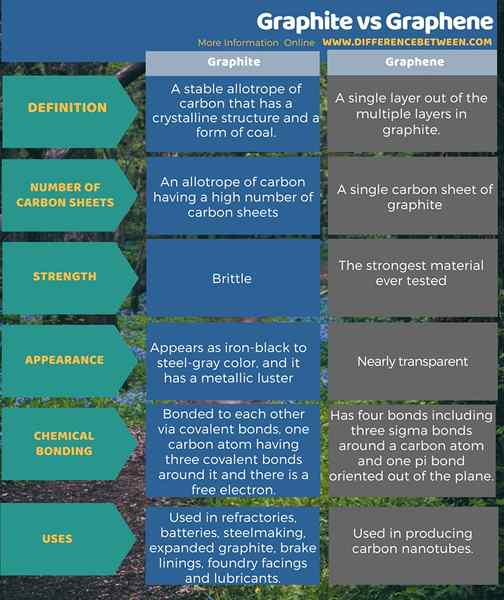
Le graphite est un allotrope stable de carbone qui a une structure cristalline et une forme de charbon. Et nous le considérons comme un minéral indigène. Un minéral natif est un élément qui se produit dans la nature sans se combiner avec aucun autre élément. De plus, c'est la forme de carbone la plus stable qui se produit dans des conditions standard. La seule unité de répétition de cet allotrope est le carbone (C). Il a un système cristallin hexagonal. Cet allotrope apparaît dans une couleur de fer noire à la gris en acier, et il a un lustre métallique. Cependant, la couleur de strie de ce minéral est noire (la couleur qui apparaît dans sa poudre fine).

Figure 01: Graphite
Nous appelons la structure du réseau de cet allotrope comme un réseau en nid d'abeille. Il a les feuilles de graphène séparées à 0 0.Distance de 335 nm. Dans la structure du réseau, les atomes de carbone sont séparés en 0.Distance 142 nm. Les atomes de carbone sont liés les uns aux autres via des liaisons covalentes, un atome de carbone ayant trois liaisons covalentes autour de lui. Puisque la valence du carbone est de 4, il y a un quatrième électron inoccupé dans chaque atome de carbone de cette structure. Par conséquent, il est libre de migrer, ce qui rend le graphite électriquement conducteur. Le graphite naturel est utile dans les réfractaires, les batteries, l'acier, le graphite étendu, les doublures de frein, les faces de fonderie et les lubrifiants.
Qu'est-ce que le graphène?
Le graphène est une seule couche hors des multiples couches en graphite. C'est un semi-métal. Cette feuille contient une seule couche d'atomes de carbone dans une structure planaire. Chaque atome de carbone a trois liaisons covalentes autour d'eux. Nous l'appelons une structure de réseau hexagonal. Contrairement au graphite, le graphène a de nombreuses propriétés rares. Plus important encore, c'est le matériau le plus fort jamais testé. Il peut effectuer efficacement la chaleur et l'électricité. Ce composé est presque transparent.

Figure 02: Fiche de graphène
Il a un diamagnétisme plus élevé que le graphite. Les feuilles de graphène sont considérées comme des nanoparticules en fonction des dimensions (la largeur de la feuille se situe entre 1 et 100 nm). Les atomes de carbone de cette feuille ont quatre liaisons, dont trois liaisons sigma autour d'un atome de carbone et une liaison PI orientée vers le plan de l'avion. Une utilisation majeure de ces feuilles est de produire des nanotubes de carbone.
Quelle est la différence entre le graphite et le graphène?
Le graphite est un allotrope stable de carbone qui a une structure cristalline et une forme de charbon. Il a un nombre élevé de feuilles de carbone. C'est cassant. De plus, les atomes de carbone de graphite sont liés les uns aux autres via des liaisons covalentes, un atome de carbone ayant trois liaisons covalentes autour de lui et il y a un électron libre. Le graphène est une seule couche hors des multiples couches en graphite. Contrairement au graphite, il s'agit d'une seule feuille de carbone. De plus, c'est le matériau le plus fort jamais testé. En dehors de cela, cette feuille de carbone comporte quatre liaisons, dont trois liaisons Sigma autour d'un atome de carbone et une liaison PI orientée hors de l'avion. Ce sont les principales différences entre le graphite et le graphène.
Résumé - Graphite vs graphène
Le graphite et le graphène sont un matériau contenant du carbone très important qui est lié les uns aux autres. La différence entre le graphite et le graphène est que le graphite est un allotrope de carbone ayant un nombre élevé de feuilles de carbone tandis que le graphène est une seule feuille de graphite en carbone.
Référence:
1. "Graphite.»Wikipedia, Wikimedia Foundation, 5 juillet 2018. Disponible ici
2. «Graphène.»Wikipedia, Wikimedia Foundation, 3 juillet 2018. Disponible ici
Image gracieuseté:
1.'Graphite-233436'by Rob Lavinsky (CC By-Sa 3.0) via Commons Wikimedia
2.'Graphène-3D-Balls'By Jynto (Talk) - Propre travaux (CC0) via Commons Wikimedia


