Différence entre le glycéraldéhyde et la dihydroxyacétone
Le différence clé entre la glycéraldéhyde et la dihydroxyacétone est que Le glycéraldéhyde est un aldéhyde, tandis que la dihydroxyacétone est une cétone.
Le glycéraldéhyde et la dihydroxyacétone sont de simples glucides. Ces deux composés ont la même formule chimique C3H6O3. Mais, leurs structures et groupes fonctionnels sont différents les uns des autres. Par conséquent, il y a une différence entre le glycéraldéhyde et la dihydroxyacétone en termes de réactivité.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le glycéraldéhyde
3. Qu'est-ce que la dihydroxyacétone
4. Similitudes entre le glycéraldéhyde et la dihydroxyacétone
5. Comparaison côte à côte - glycéraldéhyde vs dihydroxyacétone sous forme tabulaire
6. Résumé
Qu'est-ce que le glycéraldéhyde?
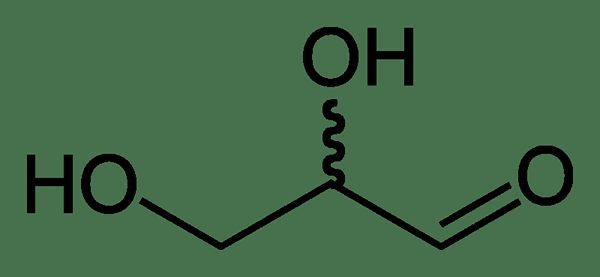
Le glycéraldéhyde est un aldéhyde simple qui est un glucides. C'est un monosaccharide triose. Cela signifie; Il a trois atomes de carbone (triose), et c'est une unité de base de sucres (monosaccharide). Sa formule chimique est C3H6O3. C'est une aldose et la plus simple parmi les aldoses. Une aldose est un monosaccharide ayant un groupe aldéhyde à la fin de la chaîne de carbone. Puisqu'il s'agit d'un monosaccharide, le glycéraldéhyde a une dégustation sucrée.
De plus, c'est un solide incolore et cristallin. Nous pouvons le trouver comme un composé intermédiaire dans le métabolisme des glucides. Le nom glycéraldéhyde vient de la combinaison de deux termes: le glycérol + l'aldéhyde. La masse molaire de ce composé est 90.07 g / mol. De plus, son point de fusion et le point d'ébullition sont respectivement de 145 ° C et 150 ° C.

Figure 01: Glycéraldéhyde
Il y a deux stéréoisomères de glycéraldéhyde car il a un atome de carbone chiral. Les deux structures sont nommées énantiomères. En laboratoire, nous pouvons préparer ce composé à partir de la légère oxydation du glycérol. Il donnera à la fois du glycéraldéhyde et de la dihydroxyacétone. Pour cette oxydation, nous pouvons utiliser du peroxyde d'hydrogène et un catalyseur comme un sel ferreux.
Qu'est-ce que la dihydroxyacétone?
La dihydroxyacétone est une cétone simple qui est un glucides. Un synonyme de ce composé est la glycérione. C'est un triose, ce qui signifie qu'il a trois atomes de carbone. La formule chimique est C3H6O3 tandis que la masse molaire est de 90.07 g / mol. Son point de fusion peut varier de 89 à 91 ° C. De plus, ce composé est hygroscopique et apparaît comme une poudre cristalline blanche. La dihydroxyacétone a un goût sucré et rafraîchissant. Il a également une odeur caractéristique. Contrairement au glycéraldéhyde, ce composé n'a pas de centre chiral, donc pas d'énantiomères. Cela signifie qu'il est optiquement inactif. Habituellement, ce composé existe sous une forme dimère.
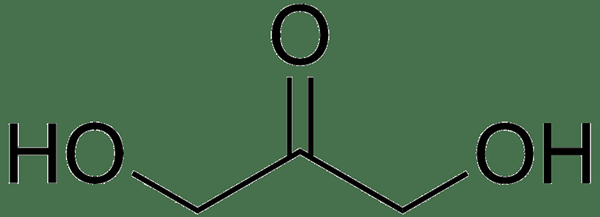
Figure 02: Dihydroxyacétone
De plus, son monomère est très soluble dans l'eau; Il est également soluble dans l'éthanol et l'acétone. La méthode de préparation est la même que pour le glycéraldéhyde car la légère oxydation du glycérol donne à la fois du glycéraldéhyde et de la dihydroxyacétone. Cependant, il existe une autre méthode pour préparer ce composé en utilisant des catalyseurs à base de glycérol et de palladium cationique en présence d'oxygène à température ambiante. Et, cette méthode donne à la dihydroxyacétone plus sélectivement, avec un rendement élevé.
Quelles sont les similitudes entre la glycéraldéhyde et la dihydroxyacétone?
- La glycéraldéhyde et la dihydroxyacétone sont de simples glucides.
- Ces deux composés ont la même formule chimique C3H6O3.
Quelle est la différence entre la glycéraldéhyde et la dihydroxyacétone?
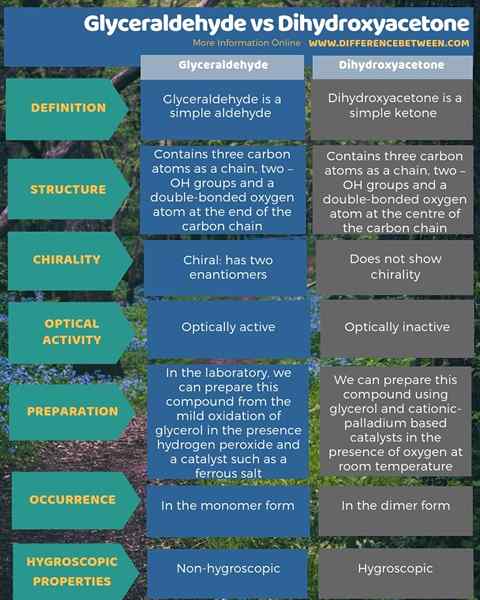
La principale différence entre le glycéraldéhyde et la dihydroxyacétone est que la glycéraldéhyde est un aldéhyde, tandis que la dihydroxyacétone est une cétone. Lorsque l'on considère la structure de ces composés, le glycéraldéhyde contient trois atomes de carbone en tant que chaîne, deux groupes -OH et un atome d'oxygène à double liaison à la fin de la chaîne de carbone; En revanche, la dihydroxyacétone contient trois atomes de carbone en tant que chaîne, deux groupes -OH et un atome d'oxygène à double liaison au centre de la chaîne de carbone.
De plus, le glycéraldéhyde est un composé chiral, et il a deux éantiomères, tandis que la dihydroxyacétone ne montre pas de chiralité. Par conséquent, le glycéraldéhyde est optiquement actif, tandis que la dihydroxyacétone est optiquement inactive. De plus, en laboratoire, nous pouvons préparer du glycéraldéhyde à partir de l'oxydation légère du glycérol en présence de peroxyde d'hydrogène et d'un catalyseur tel qu'un sel ferreux. Nous pouvons préparer la dihydroxyacétone à l'aide de catalyseurs à base de glycérol et de palladium cationique en présence d'oxygène à température ambiante. En plus de ceux-ci, le glycéraldéhyde est non hygroscopique tandis que la dihydroxyacétone est hygroscopique.
L'infographie ci-dessous résume la différence entre le glycéraldéhyde et la dihydroxyacétone.
Résumé - glycéraldéhyde vs dihydroxyacétone
En résumé, la glycéraldéhyde et la dihydroxyacétone sont de simples glucides. Cependant, la principale différence entre le glycéraldéhyde et la dihydroxyacétone est que la glycéraldéhyde est un aldéhyde, tandis que la dihydroxyacétone est une cétone.
Référence:
1.«Glycéraldéhyde.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
2.«Dihydroxyacétone.»Wikipedia, Wikimedia Foundation, 9 septembre. 2019, disponible ici.
3. Zhang, Guoqiang et Qinhong Wang. «Glucides fonctionnels.»Glucides fonctionnels, février. 2017, pp. 269-298., doi: 10.1201 / 9781315371061-9.
Image gracieuseté:
1. «Glycéraldéhyde-2d-squelettique» (domaine public) via Commons Wikimedia
2. «Dihydroxyacétone» par Edgar181 - Propre travaux (domaine public) via Commons Wikimedia


