Différence entre les radicaux libres et les espèces réactives de l'oxygène
Le différence clé entre les radicaux libres et les espèces réactives de l'oxygène est que Les radicaux libres peuvent contenir ou non des atomes d'oxygène, tandis que les espèces réactives de l'oxygène contiennent essentiellement des atomes d'oxygène.
Nous utilisons généralement les termes radicaux libres et espèces réactives de l'oxygène interchangeables parce que les espèces réactives de l'oxygène sont toujours des composés radicaux libres. Cependant, tous les radicaux libres ne sont pas des espèces réactives de l'oxygène; Ils peuvent ou non contenir des atomes d'oxygène, mais ils sont très réactifs en raison de la présence d'un électron non apparié. Par conséquent, ces deux formulaires ont tendance à réagir avec des sources appropriées pour obtenir un électron pour coupler avec leur électron non apparié afin que la configuration de l'électron devienne stable.
CONTENU
1. Aperçu et différence clé
2. Quels sont les radicaux libres
3. Que sont les espèces réactives de l'oxygène
4. Comparaison côte à côte - Oxygène atomique vs espèces d'oxygène moléculaire sous forme tabulaire
5. Résumé
Quels sont les radicaux libres?
Les radicaux libres sont des atomes réactifs ou un groupe d'atomes contenant un ou plusieurs électrons non appariés (s). Ils sont très réactifs en raison de la présence d'un électron non apparié. De plus, les radicaux libres sont très instables et ils ont tendance à se stabiliser en obtenant des électrons à l'extérieur afin de remplir les orbitales vides. Ils réagissent avec d'autres composés chimiques pour capturer l'électron nécessaire. Les radicaux libres sont des intermédiaires importants dans les processus naturels. Nous pouvons désigner les radicaux libres par un point exposant vers la droite. Par exemple, h., CL., Ho., H3C.
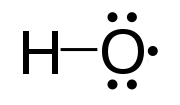
Figure 01: radical hydroxyle
Les radicaux libres à longue durée de vie sont dans trois catégories: radicaux stables, radicaux persistants et diridicaux.
- Radicaux stables: l'exemple majeur d'un radical stable est l'oxygène moléculaire o2. Les radicaux organiques contenant le système π conjugué peuvent vivre longtemps.
- Radicaux persistants: ils sont à longue durée de vie en raison de l'entrée stérique autour du centre radical et les rendent physiquement difficiles à réagir avec une autre molécule.
- Di-radicaux: certaines molécules ont deux centres radicaux; Nous les nommez comme didicaux. Oxygène moléculaire naturellement (oxygène atmosphérique).
Que sont les espèces réactives de l'oxygène
Les espèces réactives de l'oxygène sont des radicaux qui sont très réactifs et contient des électrons non appariés. La dénotation pour ce terme est ROS. Ces espèces chimiques contiennent essentiellement des atomes d'oxygène contenant un électron non apparié. Certains exemples courants incluent le peroxyde, le superoxyde, les radicaux hydroxyles, l'oxygène alpha, etc.

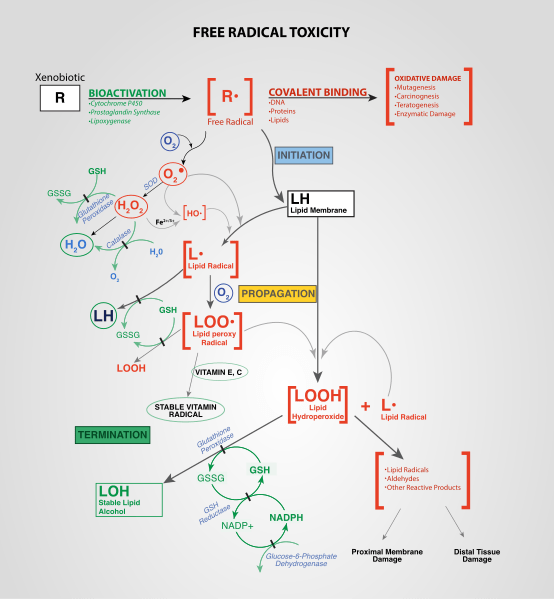
Figure 02: Formation de ROS endogène
Différentes réactions chimiques forment ces espèces réactives de l'oxygène; Par exemple, la réduction de l'oxygène moléculaire forme du superoxyde et cette espèce réactive de l'oxygène agit comme un précurseur pour de nombreuses autres formations radicales. Les peroxydes sont un autre type de ROS important qui se forment à partir de la dimanot de superoxyde.
Il existe des voies endogènes et exogènes pour produire des ROS. Par exemple, les espèces réactives de l'oxygène se forment dans diverses réactions biologiques dans les cellules et les organites telles que les peroxysomes. La production exogène de ROS fait référence à la formation d'espèces réactives de l'oxygène en raison de l'influence d'agents externes tels que les polluants, les métaux lourds, la fumée, les médicaments, etc.
Quelle est la différence entre les radicaux libres et les espèces réactives de l'oxygène?
Nous utilisons généralement les termes radicaux libres et espèces réactives de l'oxygène interchangeables parce que les espèces réactives de l'oxygène sont toujours des composés radicaux libres. Cependant, tous les radicaux libres ne sont pas des espèces réactives de l'oxygène. La principale différence entre les radicaux libres et les espèces réactives de l'oxygène est que les radicaux libres peuvent ou non contenir des atomes d'oxygène, tandis que les espèces réactives de l'oxygène contient essentiellement des atomes d'oxygène.
Vous trouverez ci-dessous un résumé de la différence entre les radicaux libres et les espèces réactives de l'oxygène.

Résumé - Radicaux libres vs espèces réactives de l'oxygène
Les radicaux libres sont des atomes réactifs ou un groupe d'atomes contenant un ou plusieurs électrons non appariés, tandis que les espèces réactives de l'oxygène sont des radicaux qui sont très réactifs et contient des électrons non appariés. La principale différence entre les radicaux libres et les espèces réactives de l'oxygène est que les radicaux libres peuvent ou non contenir des atomes d'oxygène, tandis que les espèces réactives de l'oxygène contient essentiellement des atomes d'oxygène.
Référence:
1."Les espèces réactives de l'oxygène.»Wikipedia, Wikimedia Foundation, 4 novembre. 2019, disponible ici.
2. «Quels sont les radicaux libres?”Phytochimicals, disponible ici.
3. «Radical (chimie).»Wikipedia, Wikimedia Foundation, 27 novembre. 2019, disponible ici.
Image gracieuseté:
1. «Hydroxyl Radical» par Smokeyjoe - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Toxicité des radicaux libres» par Dan Cojocari - propre travailleur (CC BY-SA 4.0) via Commons Wikimedia


