Différence entre la charge formelle et l'état d'oxydation
Le différence clé entre la charge formelle et l'état d'oxydation est que La charge formelle est la charge d'un atome dans une molécule, nous calculons en supposant que les électrons dans les liaisons chimiques sont partagés également entre les atomes tandis que l'état d'oxydation est le nombre d'électrons qu'un atome perd ou gains ou partage avec un autre atome.
La charge formelle et l'état d'oxydation sont des termes différents, bien que nous supposons généralement qu'ils sont les mêmes. La charge formelle détermine le nombre d'électrons qui se produisent autour d'un atome d'une molécule tandis que l'état d'oxydation détermine le nombre d'électrons échangés entre les atomes pendant la formation d'une molécule.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la charge formelle
3. Qu'est-ce que l'état d'oxydation
4. Comparaison côte à côte - charge formelle vs état d'oxydation sous forme tabulaire
5. Résumé
Qu'est-ce que la charge formelle?
La charge formelle est la charge d'un atome dans une molécule, nous calculons en supposant que les électrons dans les liaisons chimiques sont partagés également entre les atomes. Par conséquent, lors de la détermination de la charge formelle, nous comparons le nombre d'électrons autour d'un atome neutre et le nombre d'électrons autour de cet atome lorsqu'il est dans une molécule. Dans cette détermination de la charge formelle, nous devons attribuer les électrons de la molécule aux atomes individuels. Ici, nous devons également prendre en compte les exigences suivantes;
- Nous devons attribuer des électrons sans liaison à l'atome dans lequel les électrons non liés se produisent
- Nous devons diviser également les électrons de liaison entre les atomes partagés
La relation mathématique pour ce calcul est la suivante:
Charge formelle = (nombre d'électrons de valence dans l'atome neutre) - (nombre d'électrons de paire solitaire) - (1/2 * Electrons de paire de liaisons)
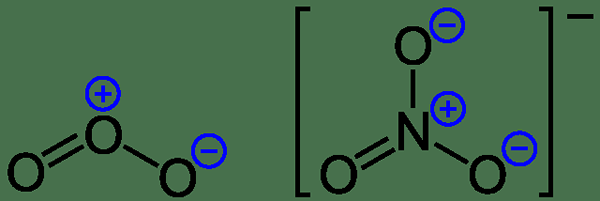
Figure 1: Charges formelles sur l'ozone et l'anion nitrate
Considérons un exemple pour comprendre ce phénomène. Pour la molécule d'ammoniac, il y a trois liaisons N-H et une paire d'électrons solitaires sur l'atome d'azote. Ensuite, quand peut calculer les suivants;
Charge formelle de n = 5 - 2 - 1/2 * 6 = 0
Charge formelle de h = 1 - 0 - 1/2 * 2 = 0
Qu'est-ce que l'état d'oxydation?
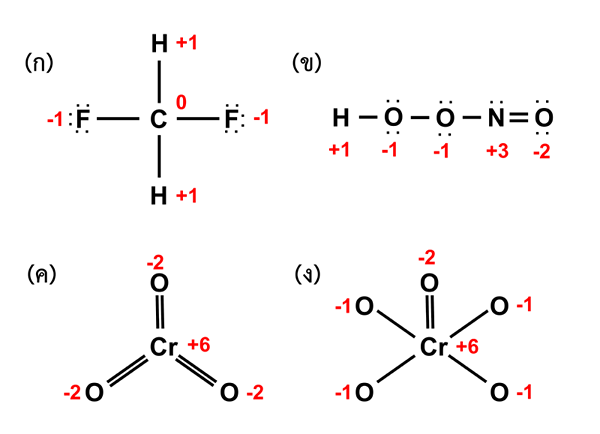
L'état d'oxydation est le nombre d'électrons qu'un atome particulier peut perdre, gagner ou partager avec un autre atome. Ce terme est appliqué à tout élément chimique dans les molécules (le terme numéro d'oxydation est appliqué principalement aux atomes métalliques centraux des complexes de coordination bien que nous utilisons ces termes interchangeables). L'état d'oxydation donne en fait le degré d'oxydation d'un atome dans un composé. Nous devons toujours donner l'état d'oxydation dans son ensemble, et il est représenté en nombre hindou-arabique, y compris la charge de l'atome. Par exemple, l'état d'oxydation du fer dans le FEO est +2.

Figure 02: états d'oxydation des atomes dans différentes molécules
Conseils pour la détermination de l'état d'oxydation:
- L'état d'oxydation d'un seul élément est nul (cela inclut également les molécules faites d'un seul élément).
- La charge totale d'une molécule ou d'une ion est la somme des charges de chaque atome.
- L'état d'oxydation des métaux alcalins est toujours +1, et pour les métaux terrestres alcalins, il est +2.
- Pendant ce temps, l'état d'oxydation du fluor est toujours -1.
- De plus, l'état d'oxydation de l'hydrogène est généralement +1. Mais parfois, c'est -1 (lorsqu'il est lié aux métaux de la Terre alcaline ou alcaline.)
- De plus, généralement, l'état d'oxydation de l'oxygène est -2 (mais dans les peroxydes et les super-oxydes, il peut varier).
- L'atome le plus électronégatif d'une molécule obtient la charge négative, et l'autre obtient la charge positive.
L'état d'oxydation est très utile pour la détermination des produits dans les réactions redox. Les réactions redox sont des réactions chimiques qui incluent l'échange d'électrons entre les atomes. Dans les réactions redox, deux demi-réactions se produisent parallèles simultanément. L'un est la réaction d'oxydation, et l'autre est la réaction de réduction. La réaction d'oxydation implique l'augmentation de l'état d'oxydation d'un atome, tandis que la réaction de réduction implique la diminution de l'état d'oxydation d'un atome.
Quelle est la différence entre la charge formelle et l'état d'oxydation?
La principale différence entre la charge formelle et l'état d'oxydation est que la charge formelle est la charge d'un atome dans une molécule que nous calculons en supposant que les électrons dans les liaisons chimiques sont partagés également entre les atomes tandis que l'état d'oxydation est le nombre d'électrons qu'un atome perd ou gains ou partage avec un autre atome. Par exemple, la charge formelle de l'atome d'azote dans la molécule d'ammoniac est 0, tandis que l'état d'oxydation est +3.
L'infographie ci-dessous résume la différence entre la charge formelle et l'état d'oxydation.

Résumé - Charge formelle vs oxydation
La charge formelle et l'état d'oxydation sont des termes différents, bien que certaines personnes supposent qu'elles sont les mêmes. La principale différence entre la charge formelle et l'état d'oxydation est que la charge formelle est la charge d'un atome dans une molécule que nous calculons en supposant que les électrons dans les liaisons chimiques sont partagés également entre les atomes tandis que l'état d'oxydation est le nombre d'électrons qu'un atome perd ou gains ou partage avec un autre atome.
Référence:
1. «2.3: frais officiels." Chemistry LibreTexts, LibreTexts, 25 juillet 2019, disponible ici.
Image gracieuseté:
1. «Principe de charge formelle V.1 ”par Jü - propre travail (domaine public) via Commons Wikimedia
2. «Affectations d'état d'oxydation» par Saranphong Yimklan - Propre travaux (domaine public) via Commons Wikimedia


