Différence entre le fluor et le fluorure

Le différence clé entre le fluor et le fluorure est que Le fluor est neutre tandis que le fluorure est chargé négativement.
Les éléments du tableau périodique, sauf les gaz nobles, ne sont pas stables. Par conséquent, les éléments essaient de réagir avec d'autres éléments pour gagner la configuration d'électrons à gaz noble et atteindre la stabilité. Le fluor est un élément qui doit également obtenir un électron pour atteindre la configuration électronique du gaz noble, néon. Tous les métaux réagissent avec le fluor, formant des fluorures. Par conséquent, il existe une différence entre le fluor et le fluorure en fonction de leurs propriétés physiques et chimiques en raison du changement d'un électron.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le fluor
3. Qu'est-ce que le fluorure
4. Comparaison côte à côte - fluor vs fluorure sous forme tabulaire
5. Résumé
Qu'est-ce que le fluor?
Le fluor est un élément du tableau périodique, qui est indiqué par f. C'est un halogène (17e groupe) dans la 2e période du tableau périodique. Le nombre atomique de fluor est de 9; Ainsi, il compte neuf protons et neuf électrons. Sa configuration d'électrons est écrite comme 12 2s2 2p5. Étant donné que le sous-niveau P devrait avoir 6 électrons pour obtenir une configuration de néon à l'électrons à gaz noble, le fluor a la capacité d'attirer un électron. Selon l'échelle de Pauling, le fluor a l'électronégativité la plus élevée dans le tableau périodique, qui est d'environ 4.
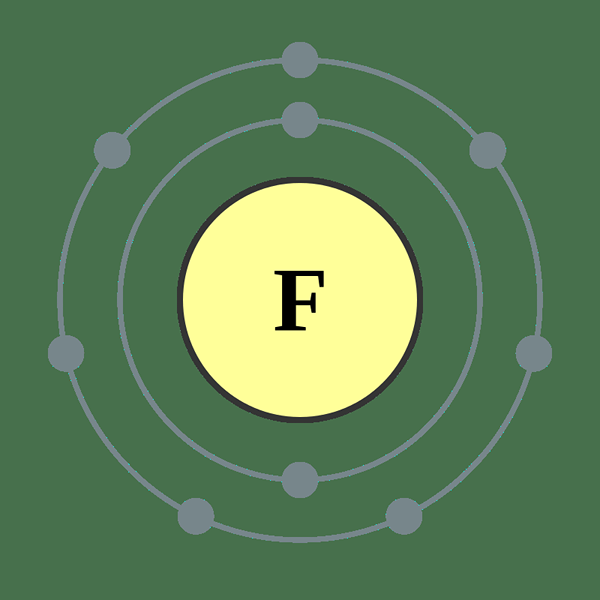
Figure 01: Atome fluor
La masse atomique du fluor est de 18.9984 AMU. À température ambiante, le fluor existe sous forme de molécule diatomique (F2). F2 est un gaz de couleur jaune pâle-jaune et il a un point de fusion de -219 ° C et un point d'ébullition de -188 ° C. Parmi les isotopes du fluor, le F-17 n'est pas un isotope stable et il a une demi-vie de 1.8 heures. Mais F-19 est un isotope stable. L'abondance de F-19 sur Terre est à 100%. Le fluor peut oxyder l'oxygène et son état d'oxydation est -1.
Le gaz fluor est plus dense que l'air et il peut également être liquéfié et solidifié. Il est très réactif, et cela est dû à sa haute électronégativité et à sa faible liaison fluor et à la fluor. De plus, les réactions de cette espèce chimique avec la plupart des autres molécules sont rapides. En raison de la réactivité, il ne se trouve pas comme un élément libre.
Qu'est-ce que le fluorure?
Le fluorure est l'anion qui se forme lorsque le fluor résume un électron d'un autre élément électropositif. Nous pouvons le représenter par le symbole F-. C'est un ion monovalent avec -1 charge. Par conséquent, il a 10 électrons et neuf protons. De plus, la configuration électronique du fluorure est 12 2s2 2p6.

Figure 02: Dillage contenant du fluorure
Le fluorure existe dans les composés ioniques tels que le fluorure de sodium, le fluorure de calcium (fluorite) et le HF. Il existe également naturellement dans les sources d'eau. On sait que cet ion aide à prévenir la carie dentaire; Par conséquent, il est ajouté au dentifrice.
Quelle est la différence entre le fluor et le fluorure?
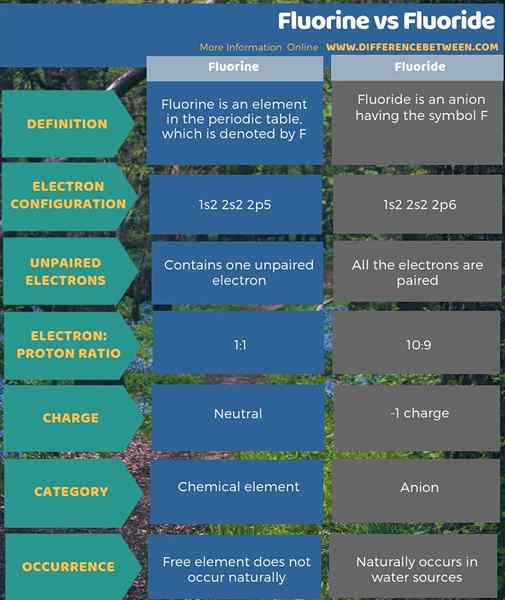
Le fluor est un élément chimique tandis que le fluorure est l'anion qu'il forme. La principale différence entre le fluor et le fluorure est que le fluor est neutre alors que le fluorure est chargé négativement. Le fluor est un élément du tableau périodique qui est indiqué par f tandis que le fluorure est un anion ayant le symbole f-. De plus, il n'y a pas d'électrons non appariés en fluor, mais il y a un électron non apparié dans l'atome de fluor. Une autre différence entre le fluor et le fluorure est que l'élément sans fluor ne se produit pas naturellement, mais le fluorure se produit naturellement dans les sources d'eau.
Résumé - Fluorine vs fluorure
Fondamentalement, le fluor est un élément chimique tandis que le fluorure est l'anion qu'il forme. La principale différence entre le fluor et le fluorure est que le fluor est neutre alors que le fluorure est chargé négativement.
Référence:
1. Miller, Bruce G. «L'effet de l'utilisation du charbon sur la santé humaine et l'environnement.»Clean Coal Engineering Technology, 2017, pp. 105-144., doi: 10.1016 / B978-0-12-811365-3.00003-x.
Image gracieuseté:
1. «Electron Shell 009 Fluorine - No Label» de Pumbaa (travail original de Greg Robson) - Fichier: Electron Shell 009 Fluorine.SVG, (CC BY-SA 2.0 UK) via Commons Wikimedia
2. «Dentifrice» par William Warby (CC par 2.0) via Flickr