Différence entre l'excitation et le potentiel d'ionisation
Différence clé - Excitation vs potentiel d'ionisation
Les deux termes potentiel d'excitation et le potentiel d'ionisation sont liés à l'énergie requise pour déplacer les électrons, mais il y a une différence entre eux en fonction de la destination du mouvement des électrons. En d'autres termes, dans ces deux situations, la destination de l'électron après le mouvement est différente. Deux mouvements d'électrons peuvent être identifiés de cette façon. Les électrons peuvent soit se déplacer vers un niveau d'énergie plus élevé dans l'atome ou la molécule ou se détacher du noyau et s'éloigner de l'atome. Ces deux processus nécessitent des quantités d'énergie définies. Les électrons ne peuvent pas bouger à moins que l'énergie requise ne soit absorbée. Le différence clé entre l'excitation et le potentiel d'ionisation est que Le potentiel d'excitation est l'énergie nécessaire pour passer d'un niveau d'énergie à d'autres alors que Le potentiel d'ionisation est l'énergie nécessaire pour éliminer un électron d'un atome.
Qu'est-ce que Potentiel d'excitation?
Les atomes ont des niveaux d'énergie qui sont appelés orbites. Les électrons se déplacent autour du noyau dans ces orbites. Les électrons ne peuvent pas choisir des orbites arbitraires; Ils sont placés dans certaines orbites en fonction de leurs niveaux d'énergie et ils sont limités à se déplacer ou à sauter vers un autre niveau d'énergie à moins qu'ils absorbent la quantité d'énergie requise. Passer d'une orbite à l'autre après avoir absorbé la quantité d'énergie requise est appelée excitation et l'énergie absorbée pour se déplacer d'une orbite vers l'autre est appelée potentiel d'excitation ou énergie d'excitation. 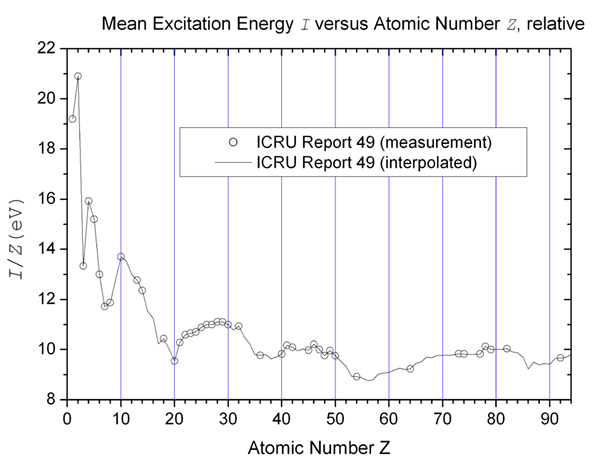
Qu'est-ce que Potentiel d'ionisation?
L'ionisation est le processus d'élimination d'un électron de la coquille de valence. En général, les électrons sont liés au noyau à travers de fortes forces électrostatiques. Par conséquent, l'énergie est nécessaire pour éliminer complètement un électron de l'atome. Ceci est défini comme le retrait d'un électron de l'atome ou de la molécule à une distance infinie. L'énergie requise pour ce processus est appelée: «énergie d'ionisation«Ou« potentiel d'ionisation ».
En d'autres termes, c'est la différence de potentiel entre l'état initial, dans lequel l'électron est délimité au noyau et à l'état final dans lequel l'électron n'est plus attaché au noyau où il se repose à l'infini.

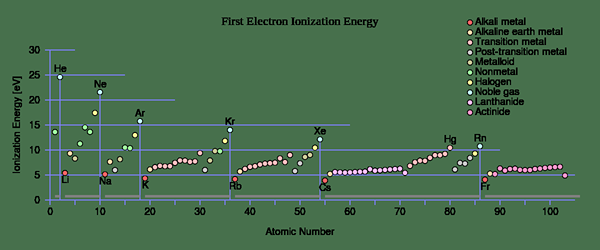
Tendances périodiques pour l'énergie d'ionisation (IE) vs. numéro de proton
Quelle est la différence entre l'excitation et le potentiel d'ionisation?
Définition de l'excitation et du potentiel d'ionisation
Potentiel d'excitation:
L'énergie absorbée par un électron pour passer d'un niveau d'énergie à un niveau d'énergie plus élevé est appelée «potentiel d'excitation» ou énergie d'excitation. C'est généralement la différence d'énergie entre l'état initial et final.
Remarque: l'électron se déplace à l'intérieur de l'atome, mais dans différents niveaux d'énergie.
Potentiel d'ionisation:
L'énergie nécessaire pour éliminer un électron d'un atome est appelée «potentiel d'ionisation» ou «énergie d'ionisation". C'est la différence de potentiel entre deux états où un électron est délimité au noyau et l'électron est retiré de l'atome. L'énergie lorsque l'électron est à une distance infinie est considérée comme zéro.
Remarque: un électron est retiré de l'atome et il n'y a pas d'attraction avec le noyau lorsqu'il est retiré.
Calcul:
Potentiel d'excitation:
Lorsqu'un électron saute de l'état fondamental (n = 1) à un autre niveau d'énergie (n = 2), l'énergie correspondante est appelée 1St potentiel d'excitation.
| 1St Potentiel d'excitation = énergie (n = 2 niveau) - Énergie (n = 1 niveau) = -3.4 ev - (-13.6 ev) = 10.2 ev |
Lorsqu'un électron saute de l'état fondamental (n = 1) à un autre niveau d'énergie, l'énergie correspondante est appelée 2ème potentiel d'excitation.
| 2nd Potentiel d'excitation = énergie (n = 3 niveau) - Énergie (n = 1 niveau) = -1.5 ev - (-13.6 ev) = 12.1 EV |
Potentiel d'ionisation:
Envisagez de retirer un électron de n = 1 niveau d'énergie. Le potentiel d'ionisation est l'énergie nécessaire pour éliminer un électron de n = 1 niveau à l'infini.
| Potentiel d'ionisation = e infini - E (n = 1 niveau)= 0 - (-13.6 ev) = 13.6 eV |
Dans les atomes, les électrons les plus liés sont éliminés en premier et le potentiel d'ionisation augmente progressivement à mesure qu'il ionise.
Image gracieuseté:
"Potentiel d'excitation moyen »par hpaul - propre travail. (Domaine public) via Wikimedia Commons
«First Ionisation Energy» par l'utilisateur: Sponk (CC BY-SA 3.0) via les communes


