Différence entre l'éthanol et l'éther diméthylique
La principale différence entre l'éthanol et l'éther diméthylique est que le L'éthanol est un liquide incolore à température ambiante qui a une volatilité élevée tandis que l'éther diméthylique est un gaz incolore à température ambiante. L'éthanol supplémentaire (le nom commun est l'alcool éthylique) est un alcool tandis que l'éther diméthylique est un éther.
Un alcool est un composé organique composé d'un groupe hydroxyle (-OH) comme groupe fonctionnel. Un éther est également un composé organique, mais il a deux groupes alkyle attachés au même atome d'oxygène.

CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'éthanol
3. Qu'est-ce que l'éther diméthylique
4. Similitudes entre l'éthanol et l'éther diméthylique
5. Comparaison côte à côte - éthanol vs éther diméthylique sous forme tabulaire
6. Résumé
Qu'est-ce que l'éthanol?
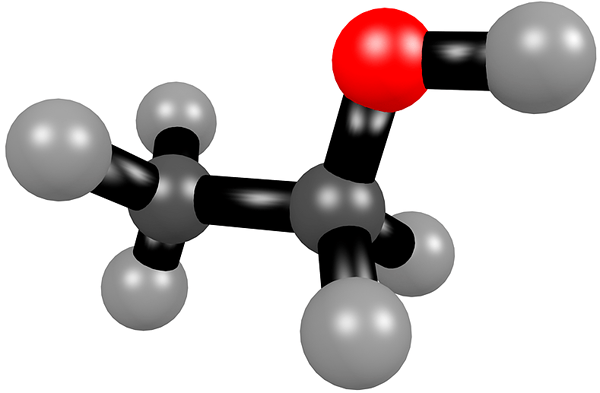
L'éthanol est un alcool ayant la formule chimique C2H5OH. Le nom commun de ce composé est alcool éthylique. Le groupe fonctionnel de ce composé est un groupe hydroxyle (-OH). L'éthanol est très inflammable; Ainsi, il est également utilisé comme carburant. De plus, c'est un composé très volatile. Cependant, à température ambiante, c'est un liquide incolore avec une odeur caractéristique.

Figure 1: Structure chimique de l'éthanol
Quelques faits chimiques sur l'éthanol
- Formule chimique = C2H6O
- Masse molaire = 07 g / mol
- Point de fusion = -114.1 ° C
- Point d'ébullition = 78.37 ° C
- État physique = à température ambiante, il existe comme un liquide incolore
- Odeur = odeur alcoolique caractéristique
- Solubilité d'eau = miscible avec l'eau
L'éthanol est miscible avec l'eau car il peut former des liaisons hydrogène avec des molécules d'eau (les groupes -OH peuvent former des liaisons hydrogène avec H2O molécules). Par conséquent, les solutions utilisées ont une viscosité élevée. De plus, la volatilité diminue lorsque l'éthanol est mélangé avec de l'eau.
L'éthanol est un composé polaire car il a un groupe hydroxyle terminal. Il fait de l'éthanol un bon solvant pour les composés polaires. Il y a deux voies pour produire de l'éthanol: les processus chimiques et les processus biologiques. Le processus chimique le plus courant est l'hydratation de l'éthylène. La voie biologique la plus courante est la fermentation des sucres par des micro-organismes.
Les utilisations de l'éthanol comprennent des applications industrielles, des applications médicales, comme carburant, comme solvant, etc. L'éthanol a également une autre utilisation comme antiseptique car elle peut tuer certains micro-organismes. De plus, l'éthanol est un antidote pour le méthanol. L'éthanol peut être utilisé directement comme carburant ou comme additif de carburant.
Qu'est-ce que l'éther diméthylique?
L'éther diméthylique est un composé d'éther ayant la formule chimique C2H6O. Le nom IUPAC de ce composé est Méthoxyméthane. Ce composé est bien connu pour ses propriétés de solvant. Il a deux groupes méthyle liés via un atome d'oxygène; Les deux groupes méthyle sont liés au même atome d'oxygène.
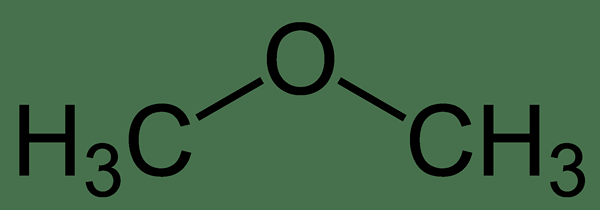
Figure 2: Structure squelettique de l'éther diméthylique
Quelques faits chimiques sur l'éther diméthylique
- Formule chimique = C2H6O
- Masse molaire = 46.07 g / mol
- Point de fusion = −141 ° C
- Point d'ébullition = −24 ° C
- État physique = à température ambiante, c'est un gaz incolore
- Odeur = odeur éther
- Solubilité dans l'eau = non soluble dans l'eau
L'éther diméthylique est un composé non polaire. Cela signifie que l'éther diméthylique n'a pas de polarité. C'est à cause de sa structure moléculaire symétrique. Par conséquent, c'est un bon solvant pour les composés non polaires. Cependant, il n'est pas réactif chimiquement par rapport aux autres composés organiques.
Quelles sont les similitudes entre l'éthanol et l'éther diméthylique?
- L'éthanol et l'éther diméthylique sont des composés organiques.
- L'éthanol et l'éther diméthylique ont la même masse molaire
- Les deux sont de bons solvants
- L'éthanol et l'éther diméthylique sont faits d'atomes C, H et O.
Quelle est la différence entre l'éthanol et l'éther diméthylique?
Éthanol vs éther diméthylique | |
| L'éthanol est un alcool ayant la formule chimique C2H5OH. | L'éther diméthylique est un composé d'éther ayant la formule chimique C2H6O. |
| Catégorie | |
| L'éthanol est un alcool. | L'éther diméthyl est un éther. |
| Point de fusion | |
| Le point de fusion de l'éthanol est de -114.1 ° C. | Le point de fusion de l'éther diméthylique est -141 ° C. |
| Point d'ébullition | |
| Le point d'ébullition de l'éthanol est de 78.37 ° C | Le point d'ébullition de l'éther diméthylique est de -24 ° C |
| État physique | |
| L'éthanol est un liquide incolore à température ambiante avec une grande volatilité. | L'éther diméthylique est un gaz incolore à température ambiante. |
| Odeur | |
| L'éthanol a une odeur alcoolique caractéristique. | L'éther diméthylique a une odeur de type éther typique. |
| Présence de groupe hydroxyle | |
| L'éthanol a un groupe hydroxyle (-OH). | L'éther diméthylique n'a pas de groupes hydroxyles. |
Résumé - Ethanol vs éther diméthylique
L'éthanol et l'éther diméthylique sont des composés organiques ayant la même masse molaire mais différentes structures chimiques. La principale différence entre l'éthanol et l'éther diméthylique est que l'éthanol est un liquide incolore à température ambiante tandis que l'éther diméthylique est un gaz incolore à température ambiante.
Référence:
1. «Ethanol.»Wikipedia, Wikimedia Foundation, 18 avril. 2018, disponible ici.
2. "Éther.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
3. "L'éther diéthylique.”Diéthyl Ether - New World Encyclopedia, disponible ici.
Image gracieuseté:
1. «1094992» (CC0) via Pixabay
2. «Diméthyl Ether Structural Formules» par Jü - Propre travaux (domaine public) via Commons Wikimedia


