Différence entre l'enthalpie et l'entropie
Le différence clé entre l'enthalpie et l'entropie est que L'enthalpie est le transfert de chaleur qui se déroule dans une pression constante tandis que l'entropie donne une idée de l'aléatoire d'un système.
À des fins d'étude en chimie, nous divisons l'univers en deux en tant que système et environnant. À tout moment, la partie que nous allons étudier est le système, et le reste est entouré. L'enthalpie et l'entropie sont deux termes décrivant les réactions qui se déroulent dans un système et l'environnement. L'enthalpie et l'entropie sont des fonctions d'état thermodynamique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'enthalpie
3. Qu'est-ce que l'entropie
4. Comparaison côte à côte - Entropie contre l'entropie sous forme tabulaire
5. Résumé
Qu'est-ce que l'enthalpie?
Lorsqu'une réaction a lieu, elle peut absorber ou évoluer la chaleur, et si nous effectuons la réaction à une pression constante, nous l'appelons l'enthalpie de la réaction. Cependant, nous ne pouvons pas mesurer l'enthalpie des molécules. Par conséquent, nous devons mesurer le changement d'enthalpie lors d'une réaction. Nous pouvons obtenir le changement d'enthalpie (∆H) pour une réaction dans une température et une pression données en soustrayant l'enthalpie des réactifs de l'enthalpie des produits. Si cette valeur est négative, alors la réaction est exothermique. Si la valeur est positive, alors la réaction est endothermique.

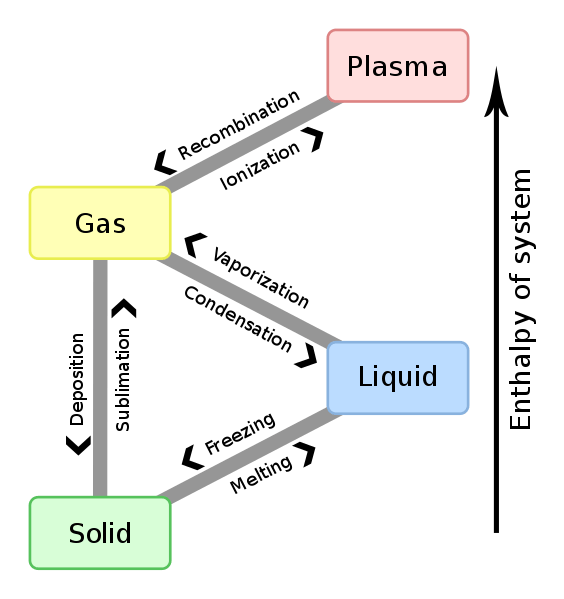
Figure 01: Relation entre le changement d'enthalpie et le changement de phase
Le changement d'enthalpie entre toute paire de réactifs et de produits est indépendant du chemin entre eux. De plus, le changement d'enthalpie dépend de la phase des réactifs. Par exemple, lorsque l'oxygène et l'hydrogène réagissent pour produire de la vapeur d'eau, le changement d'enthalpie est de -483.7 kJ. Cependant, lorsque les mêmes réactifs réagissent pour produire de l'eau liquide, le changement d'enthalpie est de -571.5 kJ.
2h2 (g) + o2 (g) → 2h2O (g); ∆H = -483.7 kJ
2h2 (g) + o2 (g) → 2h2O (l); ∆H = -571.7 kJ
Qu'est-ce que l'entropie?
Certaines choses se produisent spontanément, d'autres ne. Par exemple, la chaleur coule d'un corps chaud à un corps plus frais, mais nous ne pouvons pas observer le contraire même s'il ne viole pas la règle de conservation de l'énergie. Lorsqu'un changement se produit, l'énergie totale reste constante mais est complétée différemment. Nous pouvons déterminer la direction du changement par la distribution de l'énergie. Un changement est spontané s'il conduit à un plus grand aléatoire et au chaos dans l'univers dans son ensemble. Nous pouvons mesurer le degré de chaos, le hasard ou la dispersion d'énergie par une fonction d'état; Nous le nommez comme l'entropie.
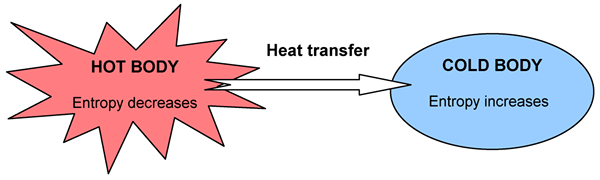
Figure 02: Un diagramme montrant le changement d'entropie avec transfert de chaleur
La deuxième loi de la thermodynamique est liée à l'entropie, et il dit: «L'entropie de l'univers augmente dans un processus spontané.»L'entropie et la quantité de chaleur générée se rapporte dans la mesure dans laquelle le système a utilisé l'énergie. En fait, la quantité de changement d'entropie ou de trouble supplémentaire causée par une quantité donnée de chaleur Q dépend de la température. S'il fait déjà très chaud, un peu de chaleur supplémentaire ne crée pas beaucoup plus de troubles, mais si la température est très basse, la même quantité de chaleur entraînera une augmentation spectaculaire du trouble. Par conséquent, nous pouvons l'écrire comme suit: (où DS est modifié à l'entropie, le DQ est modifié en chaleur et T est la température.
ds = dq / t
Quelle est la différence entre l'enthalpie et l'entropie?
L'enthalpie et l'entropie sont deux termes connexes dans la thermodynamique. La principale différence entre l'enthalpie et l'entropie est que l'enthalpie est le transfert de chaleur dans une pression constante tandis que l'entropie donne une idée de l'aléatoire d'un système. De plus, l'enthalpie se rapporte à la première loi de la thermodynamique tandis que l'entropie se rapporte à la deuxième loi de la thermodynamique. Une autre différence importante entre l'enthalpie et l'entropie est que nous pouvons utiliser l'enthalpie pour mesurer le changement d'énergie du système après la réaction alors que nous pouvons utiliser l'entropie pour mesurer le degré de désordre du système après la réaction.
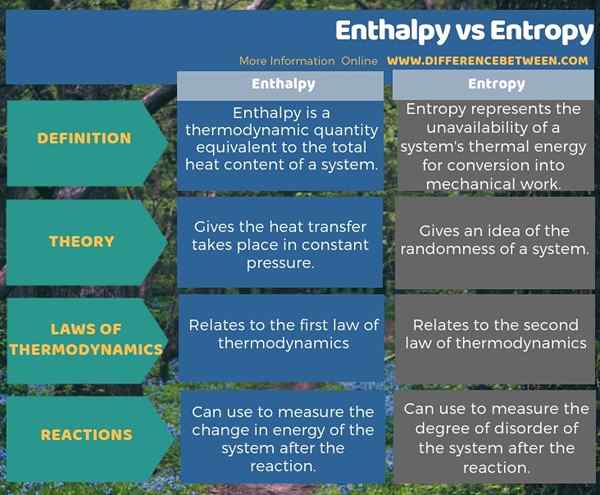
Résumé - enthalpie vs entropie
L'enthalpie et l'entropie sont des termes thermodynamiques que nous utilisons souvent avec des réactions chimiques. La principale différence entre l'enthalpie et l'entropie est que l'enthalpie est le transfert de chaleur dans une pression constante tandis que l'entropie donne une idée de l'aléatoire d'un système.
Référence:
1. LibreTexts. «Enthalpie.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
2. Drake, Gordon W.F. «Entropie.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 juin 2018. Disponible ici
Image gracieuseté:
1.«Changement de phase - en» par F l a n k e r, Penubag - propre travail, (domaine public) via Commons Wikimedia
2.«Entropy Hot to Cold» par Ibrahim Dincer et Yunus A. Cengel - Entropy 2001, 3 (3), 116-149; doi: 10.3390 / e3030116 http: // www.mdpi.com / 1099-4300 / 3/3/116, (CC par 3.0) via Commons Wikimedia


