Différence entre le point de terminaison et le point stoichiométrique
Le différence clé entre le point final et le point stoichiométrique est que Le point de terminaison vient juste après le point stœchiométrique, tandis que le point stoechiométrique est le point le plus précis auquel la neutralisation se termine.
Un titrage acide-base implique une réaction de neutralisation, qui se produit au point où un acide réagit avec une quantité chimiquement égale de base. Cependant, il y a une légère différence entre le point théorique où la réaction se termine exactement et le point où nous le détectons pratiquement. De plus, vous devez également noter que le terme point d'équivalence est un nom plus couramment utilisé pour le point stoichiométrique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le point de terminaison
3. Quel est le point stoichiométrique
4. Comparaison côte à côte - point final vs point stoichiométrique dans la forme tabulaire
5. Résumé
Qu'est-ce que le point de terminaison?
Le moment où une réaction semble être terminée est le point final du titrage. Nous pouvons déterminer expérimentalement ce point. Considérons un exemple pour comprendre pratiquement cela. Supposons que nous titrions 100 ml de 0.1 m d'acide chlorhydrique (HCl) avec 0.5 m d'hydroxyde de sodium.
HCL(aq) + Naoh(aq) ⟶ H2O + NaCl(aq)
Nous gardons l'acide dans le ballon de titrage et titrons contre NaOH en présence d'orange méthylique comme indicateur. En milieu acide, l'indicateur est incolore et il montre une couleur rose dans le milieu de base. Initialement, il n'y a que de l'acide (HCl 0.1 m / 100 ml) dans le ballon de titrage; Le pH de la solution est égal à 2. Au fur et à mesure que nous ajoutons NaOH, le pH de la solution augmente en raison de la neutralisation d'une certaine quantité d'acide dans le milieu. Nous devons ajouter la base en continu de chute jusqu'à ce qu'elle atteigne l'achèvement. Le pH de la réaction devient égal à 7 lorsque la réaction est terminée. Même à ce stade, l'indicateur ne montre aucune couleur dans le milieu car il modifie la couleur dans le milieu de base.
Pour observer le changement de couleur, nous devons ajouter une goutte de NaOH de plus, même après la fin de la neutralisation. Le pH de la solution change considérablement à ce stade. C'est le point où nous observons lorsque la réaction est terminée.
Quel est le point stoichiométrique?
Le point d'équivalence est le nom commun du point stœchiométrique. C'est le point auquel l'acide ou la base termine sa réaction de neutralisation. Une réaction est terminée théoriquement à ce stade, mais nous ne pouvons pratiquement pas observer le point exact. Il vaut mieux si nous pouvons déterminer quand le point équivalent est atteint car c'est le point exact où la neutralisation a eu lieu. Cependant, nous pouvons observer l'achèvement de la réaction au point final.

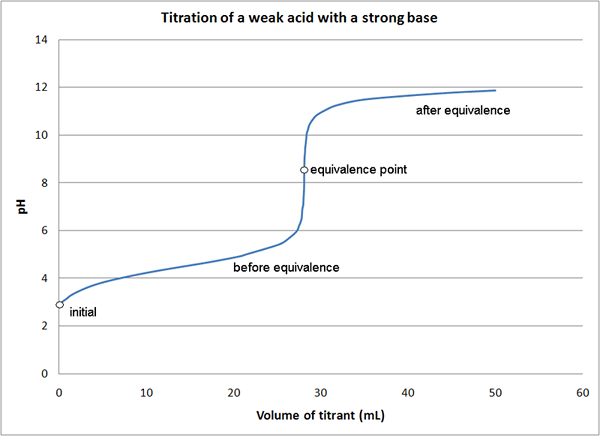
Figure 01: Graphique pour un titration montrant le point d'équivalence
Si nous considérons le même exemple que ci-dessus, au début de la réaction, nous n'avons que l'acide dans le milieu (HCL). Avant d'atteindre le point d'équivalence, avec l'ajout de NaOH, nous avons l'acide non réagi et formé un sel (HCl et NaCl). Au point d'équivalence, nous n'avons que du sel dans le milieu. Au point final, nous avons du sel et la base (NaCl et NaOH) dans le milieu.
Quelle est la différence entre le point de terminaison et le point stœchiométrique?
Le point de terminaison et le point stoichiométrique (en commun, point d'équivalence) sont toujours différents les uns des autres. La principale différence entre le point final et le point stoichiométrique est que le point final vient juste après le point stoichiométrique, tandis que le point stoichiométrique est le point le plus précis auquel la neutralisation termine. De plus, nous pouvons observer les critères d'évaluation mais ne pouvons pas observer le point stoichiométrique pratiquement.

Résumé - Point de terminaison vs point stoichiométrique
Le point de terminaison et le point stoichiométrique (en commun, point d'équivalence) sont toujours différents les uns des autres. La principale différence entre le point final et le point stoichiométrique est que le point final vient juste après le point stoichiométrique, tandis que le point stoichiométrique est le point le plus précis auquel la neutralisation termine.
Référence:
1. Helmenstine, Anne Marie. «Définition du point d'équivalence."Thoughtco, mai. 7, 2019, disponible ici.
Image gracieuseté:
1.«Titrage de l'acide faible avec une base forte» par quantumkinetics - propre travail (CC par 3.0) via Commons Wikimedia


