Différence entre étape élémentaire et étape de détermination du taux
Le différence clé Entre l'étape élémentaire et l'étape déterminant le taux est que Les étapes élémentaires sont des réactions chimiques où les réactifs réagissent pour donner un produit final ou un intermédiaire tandis que l'étape de détermination du taux est l'étape de réaction la plus lente d'un processus à plusieurs étapes.
L'étape de détermination de l'étape élémentaire et de la vitesse des termes est utilisée pour discuter de la vitesse de réaction des réactions chimiques, en particulier lorsqu'il y a deux étapes ou plus avant de former le produit final. Chaque étape de ce processus en plusieurs étapes est appelée étape élémentaire. Ces étapes ont des taux différents. L'étape de détermination du taux du processus a le taux le plus lent.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une étape élémentaire
3. Qu'est-ce qu'une étape déterminante du taux
4. Comparaison côte à côte - étape élémentaire vs étape de détermination du taux dans la forme tabulaire
5. Résumé
Qu'est-ce qu'une étape élémentaire?
Les étapes élémentaires sont les étapes uniques incluses dans un processus à plusieurs étapes. Une étape élémentaire est une réaction chimique où un ou deux réactifs réagissent pour donner un produit final ou un produit intermédiaire. C'est une étape de réaction unique, et il a un seul état de transition. Généralement, s'il n'y a pas de produits intermédiaires produits lors d'une réaction chimique particulière, cette réaction est appelée réaction élémentaire. De plus, un mécanisme pour une réaction chimique est une collection d'étapes élémentaires. Par conséquent, une réaction élémentaire décrit le moment unique pendant une réaction dans laquelle les molécules se cassent et / ou forment de nouvelles liaisons.
La somme de toutes les étapes élémentaires équilibrées donne la réaction globale. Les étapes élémentaires d'un processus en plusieurs étapes ont des taux de réaction différents; e.g. Certaines étapes élémentaires se produisent rapidement tandis que d'autres étapes sont très lentes. Par conséquent, l'étape de détermination de la vitesse ou l'étape la plus lente de la réaction est également un type de réaction élémentaire.
Les réactions élémentaires peuvent être classées en fonction de leur molécularité. Ici, le nombre de molécules impliquées dans la réaction est utilisée pour donner la molécularité de l'étape élémentaire. E.g. S'il y a un seul réactif, il est unimoléculaire, et s'il y a deux réactifs, c'est bimoléculaire. Unimoléculaire et bimoléculaire sont les types les plus courants de réactions élémentaires. Les réactions à terme (trois réactifs) sont rares car la collision de trois molécules en même temps est rare.
Qu'est-ce qu'une étape déterminante du taux?
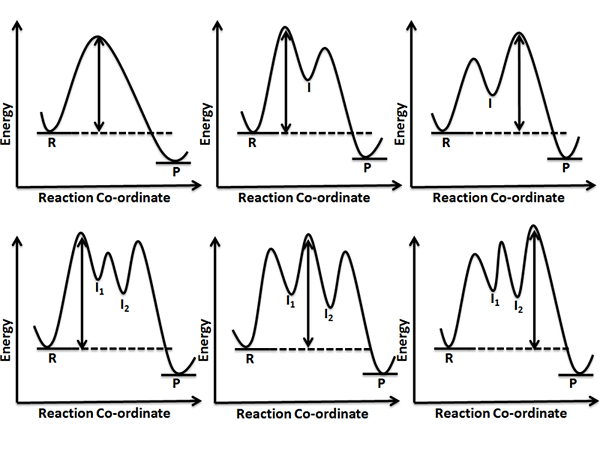
L'étape de détermination du taux est l'étape la plus lente d'un processus de réaction en plusieurs étapes. C'est une étape unique parmi une série d'étapes. Cependant, certaines réactions n'ont qu'une seule réaction chimique (pas une série de réactions); Ainsi, ces réactions sont toujours la réaction de détermination de la vitesse. La réaction ayant la vitesse la plus lente est prise comme la réaction déterminant la vitesse car elle limite la vitesse de la réaction.

Figure 01: Les flèches à double tête indiquent l'étape de détermination de la vitesse de chaque réaction
Un exemple est donné ci-dessous.
NO2 + NO2 → NO + NO3 (étape lente, déterminant du taux)
NO3 + CO → NO2 + CO2 (étape rapide)
Quelle est la différence entre l'étape élémentaire et l'étape de détermination du taux?
La principale différence entre l'étape élémentaire et l'étape de détermination de la vitesse est que les étapes élémentaires sont des réactions chimiques où les réactifs réagissent pour donner un produit final ou un intermédiaire tandis que l'étape de détermination du taux est l'étape de réaction la plus lente d'un processus à plusieurs étapes. Par conséquent, une étape élémentaire peut être rapide ou lente, tandis qu'une étape de détermination du taux est toujours l'étape la plus lente.
L'infographie ci-dessous résume la différence entre l'étape élémentaire et l'étape de détermination du taux.
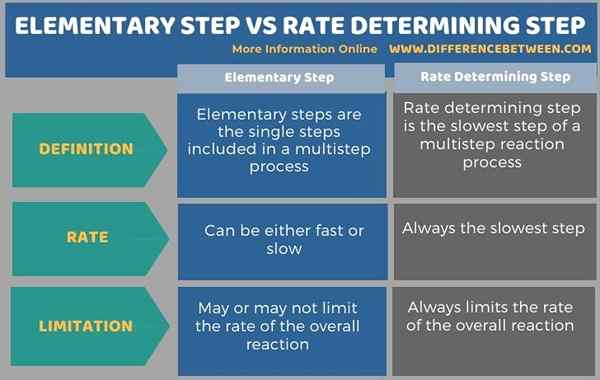
Résumé - Étape élémentaire vs étape de détermination du taux
L'étape de détermination de l'étape élémentaire et de la vitesse des termes est utilisé pour discuter de la vitesse de réaction des réactions chimiques lorsqu'il y a deux étapes ou plus avant de former le produit final. La principale différence entre l'étape élémentaire et l'étape de détermination de la vitesse est que les étapes élémentaires sont des réactions chimiques où les réactifs réagissent pour donner un produit final ou un intermédiaire tandis que l'étape de détermination du taux est l'étape de réaction la plus lente d'un processus à plusieurs étapes.
Référence:
1. «Étapes élémentaires.”Chemistry LibreTexts, LibreTexts, 19 mai 2020, disponible ici.
2. «Chimie sans limites.”Lumen, disponible ici.
3. «Réaction élémentaire.»Wikipedia, Wikimedia Foundation, 5 septembre. 2019, disponible ici.
Image gracieuseté:
1. «Diagrammes de coordonnées de réaction pour les réactions avec 0, 1, 2 intermédiaires» par Aimnature - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


