Différence entre électropositif et électronégatif
Le différence clé entre électropositif et électronégatif est que Electropositive fait référence à la capacité de perdre des électrons, formant des cations, tandis que l'électronégatif fait référence à la capacité de gagner des électrons, formant des anions.
Les termes électropositifs et électronégatifs viennent avec l'attraction ou la répulsion des éléments chimiques vers les électrons. Nous pouvons classer les éléments chimiques selon cette caractéristique; Soit ils perdent ou gagnent des électrons lors d'une réaction chimique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'électropositif
3. Qu'est-ce que l'électronégatif
4. Comparaison côte à côte - électropositive vs électronégative dans la forme tabulaire
5. Résumé
Qu'est-ce que l'électropositif?
Les moyens électropositifs signifient que les éléments chimiques ont tendance à perdre des électrons. La perte d'électrons forme des cations ou des ions chargés positivement dans des réactions chimiques. C'est une mesure de la capacité d'un élément à donner des électrons. Les éléments ont tendance à perdre leurs électrons pour gagner une configuration d'électrons à gaz noble.
Habituellement, tous les métaux sont considérés comme des éléments chimiques électropositifs car ils ont des électrons facilement amovibles dans leurs orbitales les plus externes. Parmi eux, les métaux alcalins (éléments chimiques du groupe 1) sont les éléments les plus électropositifs. Théoriquement, le francium est l'élément chimique le plus électro-électrique, bien qu'il soit de nature instable. Bien que l'hydrogène se trouve dans le groupe1 du tableau périodique, il peut perdre ou gagner des électrons; Par conséquent, nous pouvons le classer sous des éléments électropositifs et électronégatifs.
Qu'est-ce que l'électronégatif?
L'électronégatif fait référence à la capacité d'un élément chimique à gagner des électrons. Le gain d'électrons de l'extérieur forme des anions; Les anions sont les espèces chimiques chargées négativement. L'électonegativité est l'opposé de l'électropositivité. Le symbole de ce phénomène est χ. Le terme peut faire référence à l'attraction d'une paire d'électrons partagée ou d'une densité d'électrons vers elle-même. Il existe deux facteurs majeurs qui affectent l'électronégativité d'un élément chimique: le nombre atomique et la distance entre les électrons du noyau et de la valence.

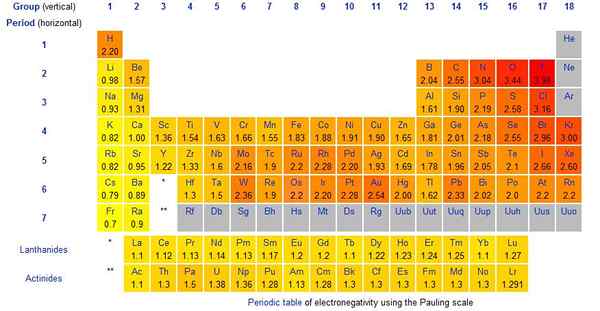
Figure 01: Valeurs d'échelle Pauling pour les éléments chimiques
L'échelle Pauling est la méthode que nous utilisons pour donner une valeur à l'électronégativité d'un élément chimique. L'échelle a été proposée par Linus Pauling. C'est une quantité sans dimension. De plus, c'est une échelle relative qui considère que l'électronégativité varie de 0.79 à 3.98. L'électronégativité de l'hydrogène est 2.20. L'élément le plus électronégatif est le fluor, et sa valeur d'échelle de pauling est 3.98 (généralement nous le prenons comme 4). Habituellement, tous les halogènes (groupes du groupe 7) sont hautement électronégatifs.
Quelle est la différence entre électropositive et électronégative?
La principale différence entre électropositive et électronégative est que le terme électropositif fait référence à la capacité de perdre des électrons, formant des cations, tandis que l'électronégatif fait référence à la capacité de gagner des électrons, formant des anions. De plus, lorsque l'on considère les éléments chimiques en haut de la liste, dans la liste des éléments électropositifs, l'élément le plus électropositif est le francium tandis que parmi les éléments électronégatifs, l'élément le plus électronégatif est le fluor.
L'échelle de Pauling est l'échelle que nous utilisons pour donner une valeur à chaque élément électropositif et électronégatif. Cependant, cette échelle donne l'électronégativité d'un élément; Par conséquent, nous pouvons déterminer qu'une valeur d'électronégativité très faible indique que l'élément est plus électropositif.
L'infographie ci-dessous résume la différence entre électropositif et électronégatif.

Résumé - électropositif vs électronégatif
Les termes électropositifs et électronégatifs décrivent l'attraction ou la répulsion des éléments chimiques vers les électrons. La principale différence entre électropositive et électronégative est que le terme électropositif fait référence à la capacité de perdre des électrons formant des cations, tandis que l'électronégatif fait référence à la capacité de gagner des électrons formant des anions anions.
L'échelle de Pauling est l'échelle que nous utilisons pour donner une valeur à chaque élément électropositif et électronégatif. L'échelle donne l'électronégativité d'un élément; Par conséquent, nous pouvons déterminer qu'une valeur d'électronégativité très faible indique que l'élément est plus électropositif.
Référence:
1.«Électronégativité.»Wikipedia, Wikimedia Foundation, 13 septembre. 2019, disponible ici.
2. «Pourquoi les métaux appelés éléments électropositifs YNOSB3SS - Chemistry.”Topperlearning, disponible ici.
Image gracieuseté:
1. «Electronégatif» par AdBlocker - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


