Différence entre l'affinité électronique et l'enthalpie des électrons
Le différence clé entre l'affinité électronique et l'enthalpie des gains d'électrons est que L'affinité électronique fait référence à la tendance d'un atome isolé à obtenir un électron, tandis que l'enthalpie du gain d'électrons est l'énergie libérée lorsqu'un atome neutre isolé gagne un électron supplémentaire.
L'affinité électronique et l'enthalpie des gains d'électrons sont deux termes connexes car l'enthalpie du gain d'électrons est une mesure concernant l'affinité électronique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'affinité électronique
3. Qu'est-ce que l'enthalpie du gain d'électrons
4. Comparaison côte à côte - Affinité électronique vs enthalpie de gain d'électrons sous forme tabulaire
5. Résumé
Qu'est-ce que l'affinité électronique?
L'affinité électronique est la quantité d'énergie libérée lorsqu'un atome neutre ou une molécule (en phase gazeux) gagne un électron de l'extérieur. Ce processus de gain d'électrons peut provoquer la formation d'une espèce chimique chargée négativement.
De plus, l'ajout d'un électron à un atome neutre ou à une molécule libère l'énergie. Nous pouvons appeler cela une réaction exothermique. Ce type de réaction se traduit par un ion négatif. Cependant, si un autre électron va être ajouté à cet ion négatif, l'énergie doit être donnée afin de poursuivre cette réaction. C'est parce que l'électron entrant est repoussé par d'autres électrons. Ce phénomène est appelé une réaction endothermique.

Les premières affinités électroniques sont des valeurs négatives et les deuxième valeurs d'affinité électronique de la même espèce sont des valeurs positives.
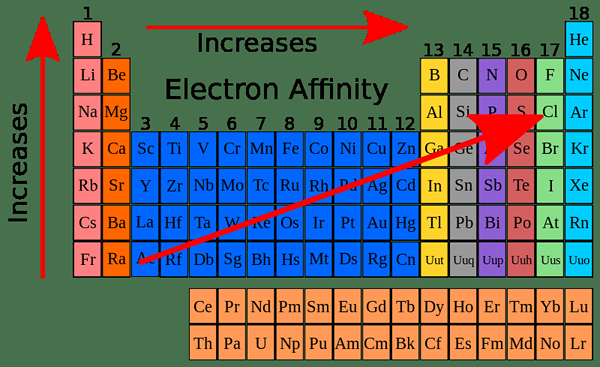
L'affinité électronique montre une variation périodique du tableau périodique. En effet. Les éléments du tableau périodique sont organisés en fonction de l'ordre croissant de leur numéro atomique. Lorsque le nombre atomique augmente, le nombre d'électrons qu'ils ont dans leurs orbitales les plus externes augmentent.
En général, l'affinité électronique devrait augmenter le long de la période de gauche à droite car le nombre d'électrons augmente le long d'une période; Ainsi, il est difficile d'ajouter un nouvel électron. Lorsqu'ils sont analysés expérimentalement, les valeurs d'affinité électronique montrent un modèle en zigzag plutôt qu'un modèle qui montre une augmentation progressive.
Qu'est-ce que l'enthalpie du gain d'électrons?
L'enthalpie du gain d'électrons est le changement d'enthalpie lorsqu'un atome neutre ou une molécule gagne un électron de l'extérieur. On peut dire que c'est la quantité d'énergie libérée lorsqu'un atome ou une molécule neutre (en phase gazeuse) gagne un électron de l'extérieur. Par conséquent, l'enthalpie du gain d'électrons est un autre terme que nous utilisons pour l'affinité électronique. L'unité pour la mesure de l'enthalpie du gain d'électrons est KJ / mol. Le nouvel ajout d'électrons provoque la formation d'une espèce chimique chargée négativement.
Cependant, il existe une distinction entre l'enthalpie des gains d'électrons et l'affinité électronique. L'enthalpie du gain d'électrons représente l'énergie libérée à l'environnement lorsqu'un électron est gagné, tandis que l'affinité électronique représente l'énergie absorbée par l'environnement lorsqu'un électron est gagné. Par conséquent, l'enthalpie du gain d'électrons est une valeur négative, tandis que l'affinité électronique est une valeur positive. Fondamentalement, les deux termes représentent le même processus chimique.
L'enthalpie du gain d'électrons nous donne une idée de la force d'un électron lié à un atome. Une quantité d'énergie libérée plus grande, l'enthalpie de gain d'électrons est élevée.
La valeur de l'enthalpie du gain d'électrons dépend de la configuration électronique de l'atome à laquelle un électron est gagné. L'ajout d'un électron à un atome neutre ou une molécule libère l'énergie. C'est ce qu'on appelle une réaction exothermique. Cette réaction se traduit par un ion négatif. L'enthalpie du gain d'électrons sera une valeur négative. Mais si un autre électron va être ajouté à cet ion négatif, l'énergie doit être donnée afin de procéder à cette réaction. C'est parce que l'électron entrant est repoussé par les autres électrons. Ce phénomène est appelé une réaction endothermique. Ici, l'enthalpie du gain d'électrons sera une valeur positive.
Quelle est la différence entre l'affinité électronique et l'enthalpie des gains d'électrons?
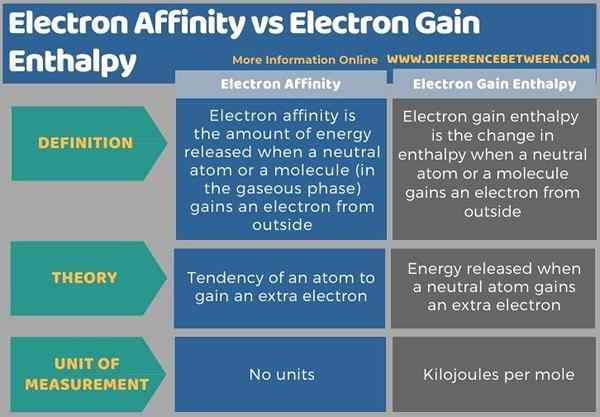
L'affinité électronique est la quantité d'énergie libérée lorsqu'un atome neutre ou une molécule (en phase gazeux) gagne un électron de l'extérieur. L'enthalpie du gain d'électrons est le changement d'enthalpie lorsqu'un atome neutre ou une molécule gagne un électron de l'extérieur. La principale différence entre l'affinité électronique et l'enthalpie du gain d'électrons est que l'affinité électronique fait référence à la tendance d'un atome isolé à obtenir un électron tandis que l'enthalpie du gain d'électrons est l'énergie qui libère lorsqu'un atome neutre isolé gagne un électron supplémentaire.
Vous trouverez ci-dessous un résumé de la différence entre l'affinité électronique et l'enthalpie du gain d'électrons sous forme tabulaire.
Résumé - Affinité électronique vs enthalpie sur le gain d'électrons
L'affinité électronique et l'enthalpie des gains d'électrons sont deux termes connexes car l'enthalpie du gain d'électrons est une mesure concernant l'affinité électronique. La principale différence entre l'affinité électronique et l'enthalpie du gain d'électrons est que l'affinité électronique fait référence à la tendance d'un atome isolé à obtenir un électron, tandis que l'enthalpie du gain d'électrons est l'énergie qui libère lorsqu'un atome neutre isolé gagne un électron supplémentaire.
Référence:
1. «Affinité électronique." Chemistry LibreTexts, LibreTexts, 26 septembre. 2020, disponible ici.
Image gracieuseté:
1. «Electron Affinity Période Table» par CDang et Adrignola (CC BY-SA 3.0) via Commons Wikimedia


