Différence entre la réduction électrolytique et le raffinage
Le différence clé entre la réduction électrolytique et le raffinage est que La méthode de réduction électrolytique utilise des électrodes en graphite de la même taille, tandis que la méthode de raffinage électrolytique utilise du métal impur comme anode et une cathode en même métal avec une pureté élevée.
La réduction électrolytique et le raffinage sont deux méthodes industrielles importantes que nous pouvons utiliser pour purifier un métal. En réduction électrolytique, nous pouvons réduire les métaux en états d'oxydation faibles, ce qui permet une extraction facile. Dans la méthode de raffinage électrolytique, le métal de l'anode impurs se déposera sur la cathode, nous permettant d'extraire le métal de la cathode.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la réduction électrolytique
3. Qu'est-ce que le raffinage électrolytique
4. Comparaison côte à côte - Réduction électrolytique vs raffinage sous forme tabulaire
5. Résumé
Qu'est-ce que la réduction électrolytique?
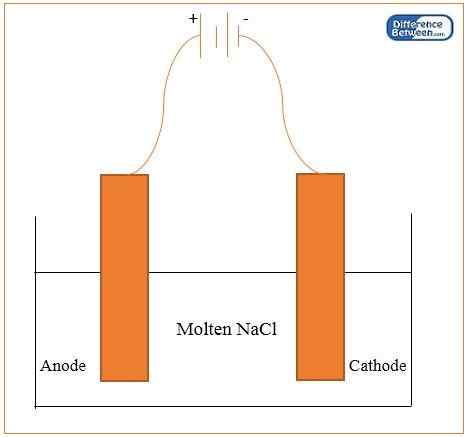
La réduction électrolytique est le processus de réduction des métaux via l'électrolyse. Dans ce processus, nous utilisons deux électrodes en graphite de la même taille que l'anode et la cathode. Le processus implique la réduction des oxydes, des hydroxydes et des chlorures de métaux (qui sont à l'état fusionné) électriquement. Ici, nous pouvons extraire ces métaux à la cathode. Les exemples de métaux que nous pouvons obtenir par le biais de cette méthode comprennent le sodium, le magnésium, le calcium et l'aluminium. Dans cette méthode, nous pouvons obtenir des métaux à haute pureté. Cependant, nous ne pouvons pas extraire des métaux avec une faible réactivité en utilisant cette technique. C'est parce qu'ils forment des oxydes moins stables.

Figure 01: Appareil pour la réduction électrolytique du sodium
Habituellement, la plupart des techniques d'extraction ne fonctionnent pas sur des métaux qui sont en haut de la série d'activités. La meilleure méthode pour leur extraction est la réduction électrolytique car ils sont hautement électropositifs, et nous ne pouvons pas utiliser le carbone comme agent réducteur pour les réduire.
Qu'est-ce que le raffinage électrolytique?
Le raffinage électrolytique est le processus d'extraction des métaux (métaux que nous pouvons obtenir à partir de toute méthode de raffinage) en utilisant l'électrolyse. Dans cette méthode, l'anode est un bloc métallique impur à partir duquel nous allons extraire le métal tandis que la cathode est un bloc du même métal à haute pureté. En outre, la solution électrolytique est une solution aqueuse du sel de ce métal particulier (le métal que nous allons extraire). Ensuite, nous pouvons passer un courant électrique à travers cette cellule électrolytique. Il provoquera la dissolution du métal de l'anode et finira par déposer sur la cathode. Par conséquent, nous pouvons récupérer le métal pur de la cathode. Les exemples incluent le raffinage d'or, le raffinage d'argent, le raffinage de cuivre, etc.
Quelle est la différence entre la réduction électrolytique et le raffinage?
La réduction électrolytique est le processus de réduction des métaux via l'électrolyse, tandis que le raffinage électrolytique est le processus d'extraction des métaux en utilisant l'électrolyse. La principale différence entre la réduction électrolytique et le raffinage est que la méthode de réduction électrolytique utilise des électrodes en graphite de même taille, tandis que la méthode de raffinage électrolytique utilise un métal impur comme anode et une cathode composée de même métal avec une pureté élevée.
De plus, la réduction électrolytique réduit électriquement les oxydes, l'hydroxyde et les chlorures de métaux, et nous pouvons finalement obtenir du métal pur par extraction. Cependant, dans le raffinage électrolytique, lors de l'application du courant électrique, le métal impur dans l'anode se dissout dans la solution électrolytique et les dépôts sur la cathode.
L'infographie ci-dessous montre plus d'informations concernant la différence entre la réduction électrolytique et le raffinage.
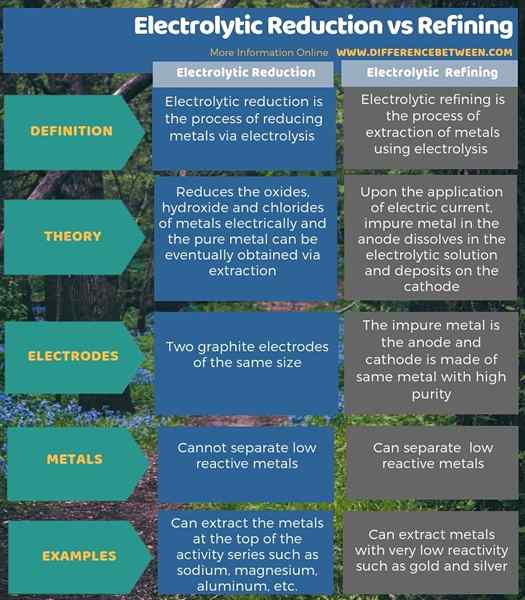
Résumé - Réduction électrolytique vs raffinage
La réduction électrolytique est le processus de réduction des métaux via l'électrolyse, tandis que le raffinage électrolytique est le processus d'extraction des métaux en utilisant l'électrolyse. La principale différence entre la réduction électrolytique et le raffinage est que la méthode de réduction électrolytique utilise des électrodes en graphite de même taille tandis que la méthode de raffinage électrolytique utilise le métal impur comme anode et une cathode composée de même métal avec une pureté élevée.
Référence:
1. Azomining, écrit par. «Refine électrolytique - Fondamentaux miniers.»Com, 25 avril. 2014, disponible ici.
2.«Métaux et non-métaux.”Chimie de réduction électrolytique, disponible ici.


