Différence entre les électrolytes et les non électrolytes
Le différence clé entre les électrolytes et les non électrolytes Les électrolytes peuvent produire des ions lorsqu'ils sont dissous dans l'eau, tandis que les non électrolytes ne peuvent pas produire d'ions.
Nous pouvons catégoriser tous les composés en deux groupes sous forme d'électrolytes et de non électrolytes en fonction de leur capacité à produire des ions et à conduire de l'électricité. Le processus de passage d'un courant à travers une solution électrolytique et de forcer les ions positifs et négatifs à se déplacer vers leurs électrodes respectives est appelée «Electrolyse."Cependant, les non électrolytes ne peuvent pas participer aux processus d'électrolyse.
CONTENU
1. Aperçu et différence clé
2. Que sont les électrolytes
3. Que sont les non électrolytes
4. Comparaison côte à côte - électrolytes vs non électrolytes sous forme tabulaire
5. Résumé
Que sont les électrolytes?
Les électrolytes sont des substances qui produisent des ions. Ces composés peuvent produire des ions lorsqu'ils sont au stade fondu, ou lorsqu'ils sont dissous dans un solvant (eau). En raison des ions, les électrolytes peuvent conduire l'électricité. Il existe également des électrolytes à semi-conducteurs. De plus, certains gaz comme le dioxyde de carbone produisent des ions (ions hydrogène et bicarbonate) lorsqu'il se dissout dans l'eau.
Il existe deux types d'électrolytes: des électrolytes forts et des électrolytes faibles. Les électrolytes forts produisent facilement des ions lorsqu'ils sont solubles. Par exemple, les composés ioniques sont des électrolytes puissants. Le chlorure de sodium fondu ou les solutions aqueuses NaCl subissent une dissociation complète (en ions Na + et Cl-); Ce sont donc de bons conducteurs d'électricité. Les acides et les bases forts sont également de bons électrolytes. Les électrolytes faibles produisent peu d'ions lorsqu'ils sont solubles dans l'eau. De plus, les acides faibles comme l'acide acétique et les bases faibles sont des électrolytes faibles.

Figure 01: Certains électrolytes en comparaison
Électrolytes dans le corps
Les électrolytes sont également présents dans notre corps. Nous en avons besoin pour maintenir l'équilibre à l'intérieur des cellules et des fluides sanguins dans un corps sain. L'équilibre électrolytique est crucial pour maintenir l'équilibre osmotique et la pression artérielle à l'intérieur du corps. N / A+, K+, et CA2+ sont importants dans la transmission des impulsions nerveuses et les contractions musculaires.
Diverses hormones dans l'homéostasie électrolyte de contrôle du corps. Par exemple, l'aldostérone contrôle le montant Na +. Les hormones de calcitonine et de parathormone jouent un rôle pour maintenir le CA2+ et po43- équilibre. Nous pouvons mesurer les niveaux d'électrolyte du sang afin d'identifier certains déséquilibres électrolytiques. Surtout, na+ et k+ Les niveaux de sang et d'urine sont importants pour vérifier le malfonctionnement rénal. Le na normal+ Le niveau de sang est de 135 à 145 mmol / L tandis que le K normal+ Le niveau est 3.5 - 5.0 mmol / L. Les niveaux extrêmes d'électrolytes dans le corps peuvent être mortels. Les électrolytes sont également importants dans les corps végétaux. Par exemple, les électrolytes (k+) Contrôlez les mécanismes d'ouverture et de clôture des stomates par les cellules de garde.
Que sont les non électrolytes?
Les composés qui ne sont pas divisés en ions positifs et négatifs lorsque nous les dissolvons dans des solvants sont des non électrolytes. Le stade fondu de ces composés ne génère pas non plus d'ions. L'absence d'ions en milieu les rend non conductrices. Surtout, les composés avec des liaisons covalentes non polaires / composés organiques appartiennent à ce groupe. Par exemple, saccharose, glucose, éthane, etc.
Quelle est la différence entre les électrolytes et les non électrolytes?
La principale différence entre les électrolytes et les non électrolytes est que les électrolytes peuvent produire des ions lorsqu'ils sont dissous dans l'eau tandis que les non électrolytes ne peuvent pas produire d'ions. Les composés ioniques et certains composés avec des liaisons polaires peuvent être des électrolytes. Les composés avec des liaisons non polaires sont principalement des non électrolytes. En outre, les électrolytes dans les solutions peuvent conduisent l'électricité contrairement aux non électrolytes.
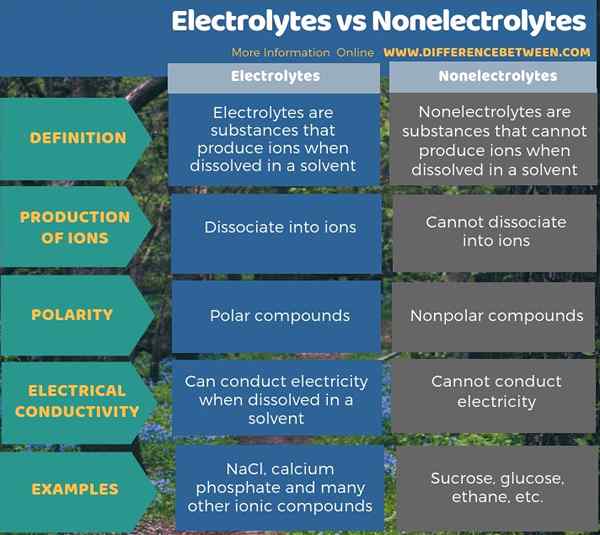
Résumé - Electrolytes vs non électrolytes
Tous les composés que nous connaissons sont des électrolytes ou des non électrolytes. La principale différence entre les électrolytes et les non électrolytes est que les électrolytes peuvent produire des ions lorsqu'ils sont dissous dans l'eau, mais les non électrolytes ne peuvent pas produire d'ions.
Référence:
1. Helmenstine, Anne Marie. «Définition et exemples d'électrolyte solide."Thoughtco, juil. 3, 2019, disponible ici.
2. Helmenstine, Anne Marie. «Exemples de chimie: électrolytes forts et faibles."Thoughtco, août. 6, 2019, disponible ici.
Image gracieuseté:
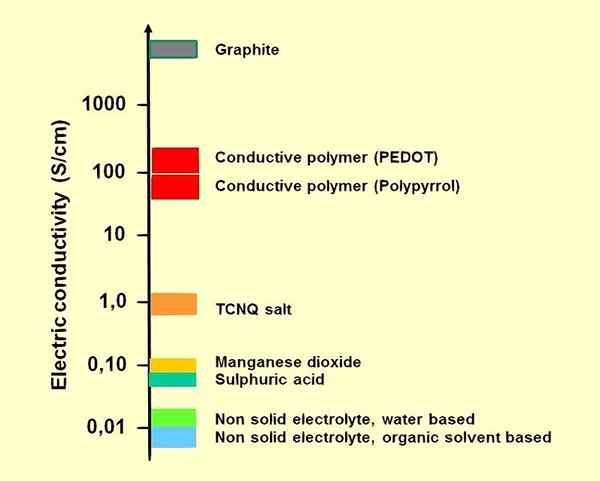
1. «CONductivité électrolytes-électriques» par ELCAP - Own Work (CC0) via Commons Wikimedia


