Différence entre les réactions E1 et E2
Différence clé - E1 vs E2 Réactions
Les réactions E1 et E2 sont deux types de réactions d'élimination qui diffèrent les unes des autres en fonction du mécanisme d'élimination; L'élimination peut être une étape ou un mécanisme en deux étapes. Le différence clé entre les réactions E1 et E2 est que Les réactions E1 ont un mécanisme d'élimination unimoléculaire tandis que les réactions E2 ont un mécanisme d'élimination bimoléculaire.
En chimie organique, les réactions d'élimination sont un type spécial de réactions chimiques dans lesquelles les substituants sont éliminés (éliminés) des composés organiques.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions E1
3. Quelles sont les réactions E2
4. Similitudes entre les réactions E1 et E2
5. Comparaison côte à côte - réactions E1 vs E2 sous forme tabulaire
6. Résumé
Quelles sont les réactions E1?
Les réactions E1 sont un type de réactions d'élimination en deux étapes trouvées en chimie organique. Dans ces réactions d'élimination, les substituants dans les composés organiques sont éliminés ou supprimés. Les mécanismes de réaction des réactions E1 sont appelés éliminations unimoléculaires.
Les réactions E1 sont des réactions en deux étapes, ce qui signifie qu'une réaction E1 se produit à travers deux étapes nommées comme ionisation et déprotonation. Dans le processus d'ionisation, un carbocation est formé en raison de l'élimination d'un substituant. Dans la deuxième étape (déprotonation), le carbocation est stabilisé par élimination d'un atome d'hydrogène comme proton.
Habituellement, les réactions E1 ont lieu avec des halogénures d'alkyle tertiaires. Mais parfois, l'halogénure d'alkyle secondaire subit également ce type de réactions d'élimination. Il y a deux raisons à cela; Les halogénures alkyles volumineux (hautement substitués) sont incapables de subir des réactions E2 et des carbocations fortement substituées sont plus stables que les carbocations primaires ou secondaires. Dans les réactions E1, la formation de carbocation est l'étape la plus lente. Par conséquent, ce sont les réactions de l'étape PF E1 de l'étape PF E1, et la vitesse de réaction ne dépend que de la concentration de l'halogénure alkyle.
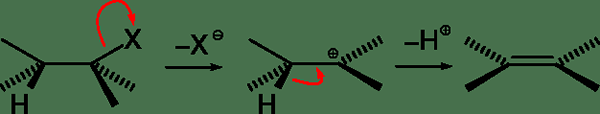
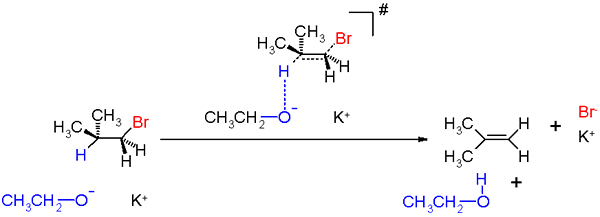
Figure 01: Mécanisme d'une réaction E1 en chimie organique
Les réactions E1 ont généralement lieu en l'absence complète de bases ou la présence de bases faibles. Des conditions acides et des températures élevées sont préférées pour une réaction E1 réussie. Et aussi, les réactions E1 incluent les étapes de réarrangement des carbocations.
Quelles sont les réactions E2?
Les réactions E2 sont un type de réactions d'élimination en une étape trouvées en chimie organique. Dans ces réactions d'élimination, les substituants dans les composés organiques sont éliminés ou éliminés en une seule étape. Les mécanismes de réaction des réactions E2 sont appelés éliminations bimoléculaires.
Le mécanisme de réaction E2 est une réaction d'élimination à pas avec un seul état de transition. Par conséquent, la rupture et la formation de la liaison chimique se produisent dans la même étape. Ce type de réactions se trouve souvent dans les halogénures d'alkyle primaires. Mais cela peut également être trouvé dans certains halogénures d'alkyle secondaires. La réaction implique deux composés; l'halogénure alkyle et une base. Par conséquent, il est connu comme une réaction bimoléculaire. Les réactions E2 se produisent en présence d'une base forte. L'exemple le plus courant pour les réactions E2 est la déshydrohalogénation.

Figure 02: un mécanisme de réaction E2
Les facteurs affectant la vitesse de réaction E2 sont la résistance de la base (la force de la base de la base est élevée, la vitesse de réaction est élevée, le type de solvant (solvants protiques polaires augmente la vitesse de réaction), la nature du groupe de départ (mieux le groupe de départ , la vitesse de réaction est élevée).
Quelles sont les similitudes entre les réactions E1 et E2?
- Les réactions E1 et E2 sont des types de réactions d'élimination.
- Les deux réactions sont privilégiées par les solvants protiques polaires.
- Les deux types de réactions peuvent être observés dans les halogénures d'alkyle secondaires.
- La vitesse des deux réactions est augmentée s'il y a de meilleurs groupes de lecture sont présents dans l'halogénure alkyle.
Quelle est la différence entre les réactions E1 et E2?
E1 vs réactions E2 | |
| Les réactions E1 sont un type de réactions d'élimination en deux étapes trouvées en chimie organique. | Les réactions E2 sont un type de réactions d'élimination en une étape trouvées en chimie organique. |
| Base | |
| La réaction E1 se produit soit en l'absence complète de bases ou en présence de bases faibles. | Les réactions E2 se produisent en présence de bases fortes. |
| Mécanisme | |
| Les mécanismes de réaction des réactions E1 sont appelés éliminations unimoléculaires. | Les mécanismes de réaction des réactions E2 sont appelés éliminations bimoléculaires. |
| Pas | |
| Les réactions E1 sont des réactions en deux étapes. | Le mécanisme de réaction E2 est une réaction d'élimination à un pas. |
| Formation de carbocation | |
| Les réactions E1 forment des carbocations comme composés intermédiaires. | Les réactions E2 ne forment aucun carbocation. |
| Autres noms | |
| Les réactions E1 sont appelées éliminations unimoléculaires. | Les réactions E2 sont appelées éliminations bimoléculaires. |
| Exemples | |
| Les réactions E1 sont courantes dans les halogénures d'alkyle tertiaires et certains halogénures d'alkyle secondaires. | Les réactions E2 sont courantes dans les halogénures d'alkyle primaires et certains halogénures d'alkyle secondaires. |
Résumé - E1 vs e2 Réactions
Les réactions d'élimination sont des réactions chimiques où les groupes de substituants sont éliminés des composés organiques; surtout des halogénures alkyles. La différence entre les réactions E1 et E2 est que les réactions E1 ont un mécanisme d'élimination unimoléculaire tandis que les réactions E2 ont un mécanisme d'élimination bimoléculaire.
Référence:
1.«Réaction d'élimination.»Wikipedia, Wikimedia Foundation, 16 mars. 2018. Disponible ici
2.«14.3: Élimination par les mécanismes E1 et E2.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
Image gracieuseté:
1.'E1-Mechanism' par Matthias M. - Propre travail, (domaine public) via Commons Wikimedia
2.«E2 Elimination Reaction» par V8rik à la langue anglaise Wikipedia, (CC By-Sa 3.0) via Commons Wikimedia


