Différence entre la double liaison et la liaison unique
Le différence clé entre la double liaison et la liaison unique est que, Dans une seule formation d'obligations, Deux atomes partagent Une paire d'électrons seulement entre alors que, dans une formation à double liaison, deux atomes partagent deux paires d'électrons.
Comme proposé par le chimiste américain G.N.Lewis, les atomes sont stables lorsqu'ils contiennent huit électrons dans leur coquille de valence. La plupart des atomes ont moins de huit électrons dans leurs coquilles de valence (à l'exception des gaz nobles dans le groupe 18 du tableau périodique); Par conséquent, ils ne sont pas stables. Ces atomes ont tendance à réagir entre eux, à devenir stable. Ainsi, chaque atome peut atteindre une configuration électronique à gaz noble. Et cela peut se produire en formant des obligations ioniques, des obligations covalentes ou des obligations métalliques. Parmi ceux-ci, la liaison covalente est spéciale. Les obligations simples et doubles relèvent de cette catégorie d'obligations.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la double liaison
3. Qu'est-ce que une seule liaison
4. Comparaison côte à côte - Double liaison vs liaison unique sous forme tabulaire
5. Résumé
Qu'est-ce que la double liaison?
Formulaires à double liaison lorsque deux atomes partagent deux paires d'électrons entre elles pour remplir les orbitales de valence. Les liaisons doubles sont plus courtes que les liaisons simples mais plus fortes qu'elles. Sp2 L'hybridation permet aux atomes de former des doubles liaisons.
Les doubles liaisons peuvent être de deux types. Des deux obligations, l'une est une obligation sigma. Il se forme via le chevauchement linéaire de deux sp2 orbitales hybrides. Deuxièmement, l'autre obligation (que nous nommons en tant que Bond Pi) se forme via le chevauchement latéral de deux orbitales P.
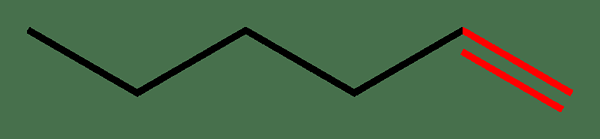
Figure 01: double liaison en couleur rouge
L'exemple commun d'une molécule avec une double liaison est l'éthylène. En éthylène, la double liaison se situe entre deux atomes de carbone. Cependant, à part les atomes similaires, ce type de liaisons peut également se former entre différents atomes comme dans les exemples du carbone carbonyle (c = o), imines (c = n), composés azo (n = n) etc.
Qu'est-ce que une seule liaison?
Formes de liaison unique lorsque deux atomes avec une différence d'électronégativité similaire ou faible partagent une paire d'électrons. Ces deux atomes peuvent être de même type ou différents types. Par exemple, lorsque le même type d'atomes se joint pour former des molécules comme Cl2, H2, ou p4, Chaque atome se lie à un autre par une seule liaison covalente.
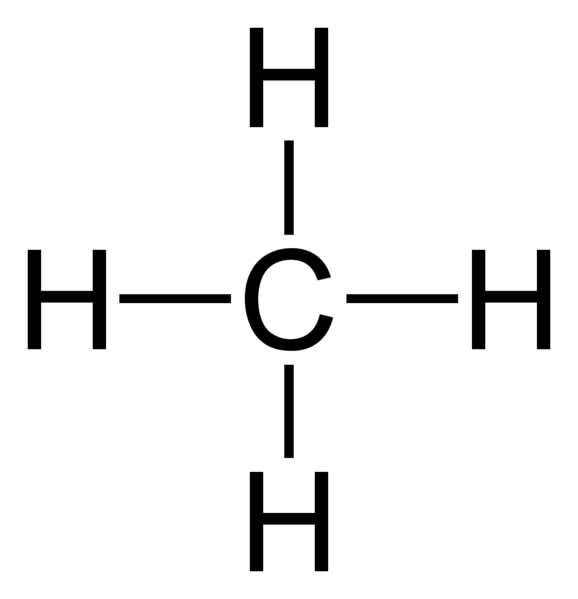
Molécule de méthane (ch4) a une seule liaison covalente entre deux types d'éléments (atomes de carbone et d'hydrogène). De plus, le méthane est un exemple pour une molécule ayant des liaisons covalentes entre les atomes avec une différence d'électronégativité très faible.

Figure 02: Structure de la molécule de méthane
Nous nommons également des obligations covalentes comme obligations sigma. Une seule liaison donne à une molécule la capacité de subir une rotation autour de cette liaison concernant. Par conséquent, cette rotation permet à une molécule d'avoir des structures conformationnelles différentes. De plus, ce type de liaisons se forme avec SP3 atomes hybrides d'une molécule. Quand deux SP égaux3 molécules hybrides se chevauchent linéairement, une seule liaison se forme.
Quelle est la différence entre la double liaison et la liaison unique?
Les obligations covalentes sont principalement de trois types; obligations simples, doubles obligations et triple liaisons. La principale différence entre la double liaison et la liaison unique est que, dans une seule formation de liaisons, une seule paire d'électrons est partagée entre deux atomes alors que, dans une formation à double liaison, deux paires d'électrons sont partagées.
De plus, une différence vitale entre la double liaison et la liaison unique est que la liaison unique résulte de la chevauchement de deux orbitales hybrides SP3 tandis que les doubles liaisons résultent d'un chevauchement linéaire de deux orbitales hybrides SP2 et par chevauchement latéral de l'orbital p.
En dehors de cela, une seule obligation contient une obligation Sigma, tandis qu'une double obligation contient une obligation sigma et une obligation PI. Par conséquent, cela affecte la longueur de liaison entre les atomes. Par conséquent, conduisant à une autre différence entre la double liaison et la liaison unique. C'est-à-dire; La longueur d'une seule liaison est supérieure à celle d'une double liaison. De plus, l'énergie de dissociation à double liaison est relativement plus élevée que l'énergie de dissociation de liaison unique.
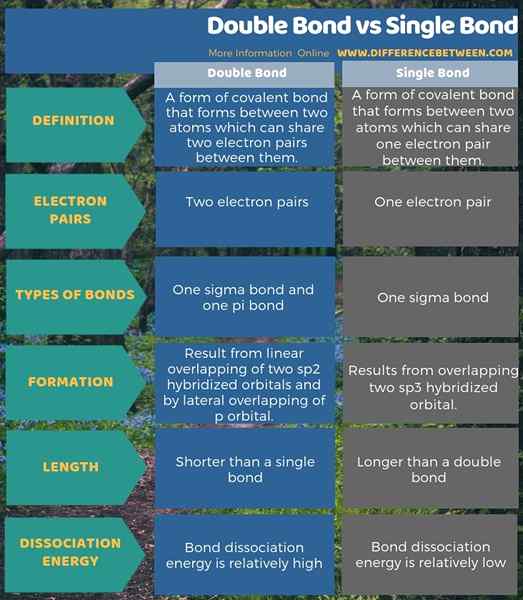
Résumé - Double obligation vs obligation unique
Les doubles liaisons et les liaisons simples sont des types de liaisons chimiques covalentes. La principale différence entre la double liaison et la liaison unique est que, dans une seule formation de liaisons, une seule paire d'électrons est partagée entre deux atomes alors que, dans une formation à double liaison, deux paires d'électrons sont partagées.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition à double liaison et exemples en chimie.”Thoughtco, dec. 5, 2018. Disponible ici
Image gracieuseté:
1.«Squelettique-Formule-terminal-Double-Bond» (domaine public) via Commons Wikimedia
2.«Méthane-2d-carré» (domaine public) via Commons Wikimedia


