Différence entre la dilution et le facteur de dilution

Différence clé - Dilution vs Facteur de dilution
Dilution et facteur de dilution sont des termes courants utilisés pour les calculs en chimie analytique. La dilution fait référence à la diminution de la concentration d'un soluté particulier dans une solution. Ce terme peut être utilisé pour décrire les liquides et les gaz. Le facteur de dilution est une mesure de la dilution; il décrit l'étendue de la dilution. La principale différence entre la dilution et le facteur de dilution est que La dilution d'une solution est la diminution de la concentration de solutés dans cette solution tandis que le facteur de dilution est le rapport entre le volume final et le volume initial de la solution.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la dilution
3. Quel est le facteur de dilution
4. Comparaison côte à côte - dilution vs facteur de dilution sous forme tabulaire
5. Résumé
Qu'est-ce que la dilution?
La dilution d'une solution est la diminution de la concentration de solutés dans cette solution. Une solution est composée d'un solvant qui a dissous des solutés. La concentration de ces solutés est donnée sous forme de molarité ou de molalité. La molarité est la quantité de solutés présents dans un volume unitaire de solution (donné par l'unité MOL / L). La molalité est la masse de soluté présente dans un volume unitaire (donné par l'unité kg / L). Lorsque la concentration du soluté dans cette solution est diminuée, elle est appelée solution diluée.
Une dilution se fait en ajoutant simplement plus de solvant à la solution, en maintenant le contenu du soluté une constante. Par exemple, une solution aqueuse contenant du chlorure de sodium (NaCl) peut être diluée en ajoutant plus d'eau. Si le soluté est un composé coloré, la couleur de la solution s'estompe lorsque la solution est diluée.

Figure 1: La couleur est décolorée lorsqu'elle est diluée
Calcul de concentration finale
La concentration finale de la solution peut être déterminée en utilisant la relation suivante.
C1v1 = C2v2
C1 est la concentration initiale
V1 est le volume initial
C2 est la concentration finale
V2 est le volume final de la solution.
Ex: Une solution aqueuse de KCL contient 2.0 moles de KCl en 0.2 L d'eau. Quelle serait la concentration finale de la solution KCl si l'eau (400 ml) est ajoutée?
Concentration initiale de KCl (C1) = 2.0 mol / 0.2L = 10 mol / L
Volume initial de la solution (v1) = 0.2 L
Volume final de la solution (v2) = 0.2 L + 0.4 L = 0.6 L
La concentration finale de solution (C2) peut être déterminée en utilisant:
C1v1 = C2v2
10 mol / L x 0.2 L = C2 x 0.6 L
C2 = 2 mol / 0.6 l = 3.33 mol / L
Quel est le facteur de dilution?
Facteur de dilution (également connu sous le nom de rapport de dilution) est le rapport entre le volume final et le volume initial de la solution. Le volume final est le volume de la solution après dilution. Le volume initial est le volume de solution avant les dilues, ou le volume de solution d'origine utilisée pour la dilution. Cette relation peut également être utilisée avec la masse du soluté.
Calcul du facteur de dilution
Facteur de dilution = volume final (V2) / volume initial (V1)
Ex: Dilution de 200 ml de KMNO4 solution aqueuse en ajoutant 200 ml d'eau,
Facteur de dilution = (200 ml + 200 ml) / 200 ml
= 400 ml / 200 ml
= 2
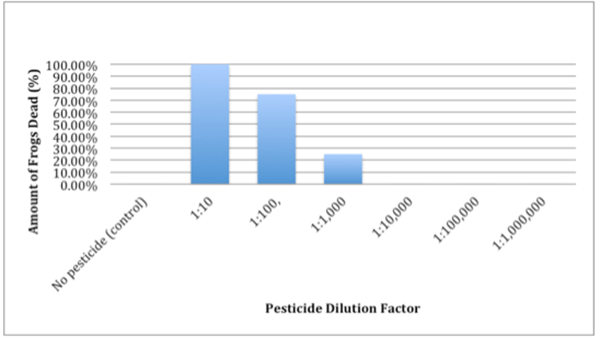
Figure 02: graphique du facteur de dilution
Le diagramme ci-dessus montre un graphique d'une recherche dans laquelle la mort des grenouilles est calculée avec la dilution des pesticides ajoutés à un écosystème.
Quelle est la différence entre la dilution et le facteur de dilution?
Dilution vs facteur de dilution | |
| La dilution d'une solution est la diminution de la concentration de solutés dans cette solution. | Le facteur de dilution (rapport de dilution) est le rapport entre le volume final et le volume initial de la solution. |
| Concept | |
| La dilution est la diminution de la concentration. | Le facteur de dilution est une mesure de la dilution. |
| Détermination | |
| La dilution est déterminée par l'équation C1v1 = C2v2. | Le facteur de dilution est déterminé en divisant le volume final de la solution à partir du volume initial. |
| Unité | |
| La dilution donne la concentration finale en unités mol / L. | Le facteur de dilution est sans unité. |
Résumé - Dilution vs facteur de dilution
La dilution et le facteur de dilution sont des termes très courants en chimie. Le facteur de dilution est la mesure de la dilution. La principale différence entre la dilution et le facteur de dilution est que la dilution d'une solution est la diminution de la concentration de solutés dans cette solution tandis que le facteur de dilution est le rapport entre le volume final et le volume initial de la solution.
Référence:
1. «Dilution (équation).»Wikipedia, Wikimedia Foundation, 12 février. 2018, disponible ici.
2. «Dilutions: explications et exemples.»Quansys Biosciences, disponibles ici.
Image gracieuseté:
1. «Dilution de diffusion» par Tess Watson (CC par 2.0) via Flickr
2. «Figure 1 Xenopus Laevis» par Krmeyer0717 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


