Différence entre le deutérium et le tritium
Le différence clé entre le deutérium et le tritium est que Le noyau du deutérium a un neutron tandis que le noyau tritium a deux neutrons.
L'hydrogène est le premier et le plus petit élément du tableau périodique, que nous désignons H. Il a un électron et un proton. Nous pouvons le catégoriser sous le groupe 1 et la période 1 dans le tableau périodique en raison de sa configuration d'électrons: 1S1. L'hydrogène peut prendre un électron pour former un ion chargé négativement, ou peut facilement donner l'électron pour produire un proton chargé positivement. Sinon, il peut partager l'électron pour faire des liaisons covalentes. En raison de cette capacité, l'hydrogène est présent dans un grand nombre de molécules, et c'est un élément très abondant de la terre. L'hydrogène a trois isotopes comme protium-1h (pas de neutrons), deutérium-2h (un neutron) et du tritium-3H (deux neutrons). Protium est le plus abondant parmi ces trois, ayant une abondance relative d'environ 99%.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le deutérium
3. Qu'est-ce que le tritium
4. Comparaison côte à côte - Deuterium vs Tritium sous forme tabulaire
5. Résumé
Qu'est-ce que le deutérium?
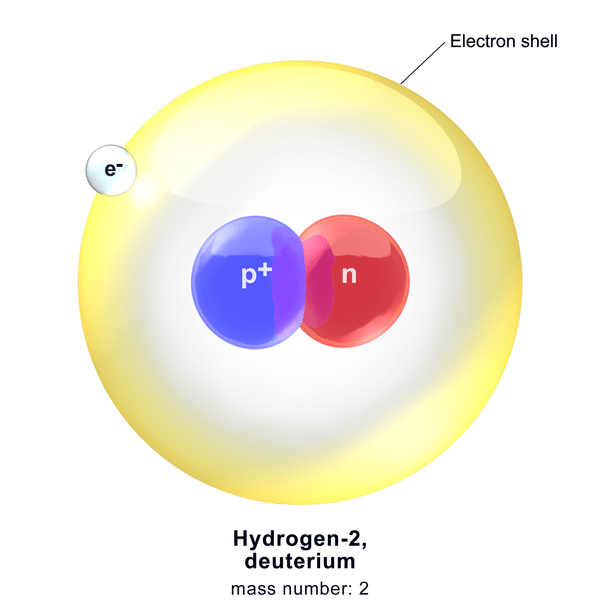
Le deutérium est l'un des isotopes de l'hydrogène. C'est un isotope stable avec 0.015% Abondance naturelle. Il y a un proton et un neutron dans le noyau du deutérium. Par conséquent, son nombre de masse est de deux et le nombre atomique est un. Nous appelons cet isotope comme de l'hydrogène lourd et est montré comme 2H. Cependant, le plus souvent, nous le représentons avec D.

Figure 1: Deuterium
Le deutérium peut exister comme molécule gazeuse diatomique avec la formule chimique D2. Cependant, la possibilité de rejoindre deux atomes D dans la nature est faible en raison de la basse abondance de celui-ci. Par conséquent, cet isotope se lie principalement à un atome de 1H faisant un gaz -HD (deutéride d'hydrogène). De plus, deux atomes de deutérium peuvent se lier à l'oxygène pour former l'analogue de l'eau D2O, que nous appelons l'eau lourde.
De plus, les molécules atteints de deutérium présentent des propriétés chimiques et physiques différentes que les analogues d'hydrogène d'entre eux. Par exemple, il peut présenter un effet isotopique cinétique. De plus, les composés deutérés présentent des différences caractéristiques dans la RMN, l'IR et la spectroscopie de masse; Par conséquent, nous pouvons l'identifier en utilisant ces méthodes. De plus, le deutérium a une tournure. Par conséquent, dans la RMN, le couplage de cet isotope donne un triplet. De plus, il absorbe une fréquence IR différente de celle de l'hydrogène dans la spectroscopie IR. En raison de la grande différence de masse, dans la spectroscopie de masse, le deutérium peut être distingué de l'hydrogène.
Qu'est-ce que le tritium?
Le tritium est l'isotope de l'hydrogène dont le nombre de masse est trois. Par conséquent, le noyau du tritium a un proton et deux neutrons. Il n'existe que de trace dans la nature en raison de sa radioactivité. Pour cette raison, il doit être produit artificiellement pour une utilisation pratique.
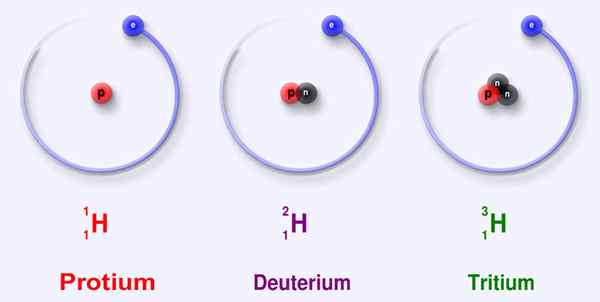
Figure 02: Trois principaux isotopes de l'hydrogène
Le tritium est un isotope radioactif (c'est le seul isotope radioactif de l'hydrogène). Il a une demi-vie de 12 ans, et il se désintègre en émettant une particule bêta pour produire de l'hélium-3. La masse atomique de cet isotope est 3.0160492. En outre, il existe sous forme de gaz (HT) à la température et à la pression standard. De plus, il peut former l'oxyde (HTO), que nous appelons «l'eau tritiée.»Tritium est utile pour fabriquer des armes nucléaires et comme traceur dans les études biologiques et environnementales.
Quelle est la différence entre le deutérium et le tritium?
Le deutérium et le tritium sont deux isotopes d'hydrogène. La principale différence entre le deutérium et le tritium est que le noyau de deutérium a un neutron tandis que le noyau tritium a deux neutrons. De plus, le nombre de masse de deutérium est 2.0135532 tandis que le nombre de masse de tritium est 3.0160492. C'est donc une autre différence significative entre le deutérium et le tritium.
De plus, une autre différence entre le deutérium et le tritium est que le deutérium est un isotope stable et que nous pouvons le trouver dans la nature tandis que le tritium est un isotope radioactif que nous ne pouvons pas le trouver dans la nature. Cependant, nous pouvons le produire artificiellement pour une utilisation pratique.

Résumé - Deuterium vs Tritium
Le deutérium et le tritium sont des isotopes de l'élément chimique hydrogène. La principale différence entre le deutérium et le tritium est que le noyau du deutérium a un neutron tandis que le noyau du tritium a deux neutrons. De plus, le tritium est radioactif tandis que le deutérium est un isotope stable.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Faits de deutérium.”Thoughtco, avril. 2, 2019, disponible ici.
Image gracieuseté:
1. «Blausen 0527 Hydrogen-2 Deuterium» par Bruceblaus - Propre travaux (CC par 3.0) via Commons Wikimedia
2. «Protium deuterium tritium» par la version française, de Dirk Hünniger - Self, traduction de Dirk Hünniger (Wikipedia allemande) (CC By-Sa 3.0) via Commons Wikimedia


