Différence entre le rayon covalent et le rayon métallique
Le différence clé entre le rayon covalent et le rayon métallique est que le Le rayon covalent est la moitié de la distance entre deux atomes homonucléaires qui sont dans une liaison covalente, tandis que le rayon métallique est la moitié de la distance entre deux ions métalliques adjacents dans une structure métallique.
Le rayon covalent et le rayon métallique sont la moitié des distances entre les noyaux atomiques; Dans le rayon covalent, nous considérons les atomes du même élément chimique ayant une seule liaison covalente entre eux, tandis que dans le rayon métallique, nous considérons les ions métalliques adjacents.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le rayon covalent
3. Qu'est-ce que le rayon métallique
4. Comparaison côte à côte - rayon covalent vs rayon métallique sous forme tabulaire
5. Résumé
Qu'est-ce que le rayon covalent?
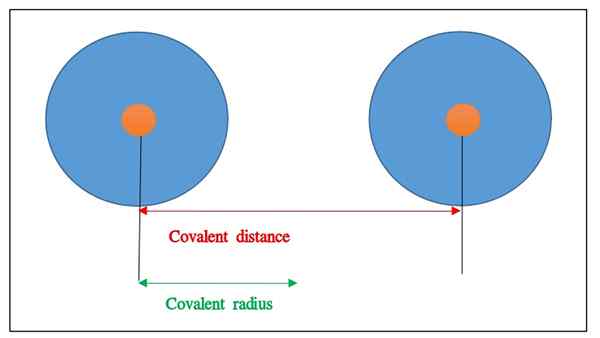
Le rayon covalent est la moitié de la séparation internucléaire entre les noyaux de deux atomes à liaison unique de la même espèce. Cela signifie; Le rayon covalent est égal à la moitié de la distance entre deux noyaux atomiques homonucléaires et ces atomes ont une seule liaison covalente entre elles. Nous pouvons le désigner par rcasse. Généralement, nous mesurons cette valeur en utilisant des méthodes de diffraction des rayons X. Parfois, nous devrons peut-être mesurer le rayon covalent pour les éléments chimiques ayant plusieurs allotropes. Là, nous pouvons déterminer le rayon en prenant la moyenne des distances de liaison entre les atomes dans chaque allotrope. De plus, les valeurs de cette mesure sont en picomètre (PM) ou en échelle angstrom. Cependant, nous ne devons pas confondre radiant covalent avec la distance covalente, qui est la distance totale entre les noyaux atomiques de deux atomes.

Figure 01: Distance covalente et rayon covalent
Qu'est-ce que le rayon métallique?
Le rayon métallique est la moitié de la distance entre deux ions métalliques adjacents dans une structure métallique. La valeur de ce rayon dépend de la nature des ions métalliques et de leur environnement également. De plus, le rayon métallique diminue le long d'une période du tableau périodique. Cela est dû à l'augmentation de la charge nucléaire efficace. De plus, le rayon métallique augmente un groupe dans le tableau périodique car le principal nombre quantique augmente dans un groupe.
Quelle est la différence entre le rayon covalent et le rayon métallique?
La principale différence entre le rayon covalent et le rayon métallique est que le rayon covalent est la moitié de la distance entre deux atomes homonucléaires qui sont dans une liaison covalente, tandis que le rayon métallique est la moitié de la distance entre deux ions métalliques adjacents dans une structure métallique. De plus, nous considérons deux atomes du même élément chimique lors de la mesure du rayon covalent, mais dans le rayon métallique, nous considérons deux ions métalliques qui sont adjacents les uns aux autres dans une structure métallique.
De plus, il n'y a pas de tendances particulières pour le rayon covalent des éléments chimiques, mais pour le rayon métallique, le rayon diminue le long d'une période et augmente le groupe du tableau périodique. Ainsi, nous pouvons considérer cela aussi comme une différence entre le rayon covalent et le rayon métallique.

Résumé - rayon covalent vs rayon métallique
Le rayon covalent et le rayon métallique sont deux termes différents. En bref, la principale différence entre le rayon covalent et le rayon métallique est que le rayon covalent est la moitié de la distance entre deux atomes homonucléaires qui sont dans une liaison covalente, tandis que le rayon métallique est la moitié de la distance entre deux ions métalliques adjacents dans une structure métallique.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Quelle est la différence entre le rayon atomique et le rayon ionique?”Thoughtco, dec. 5, 2018, disponible ici.
2. LibreTexts. «Distance de liaison covalente, rayon et rayon de van der Waals.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.


