Différence entre la covalence et l'état d'oxydation
Différence clé - covalence contre État d'oxydation
Les atomes de différents éléments chimiques sont liés les uns aux autres formant différents composés chimiques. Dans la formation d'un composé, les atomes sont liés les uns aux autres via des liaisons ioniques ou des liaisons covalentes. La covalence et l'état d'oxydation sont deux termes qui décrivent l'état de ces atomes dans les composés chimiques. La covalence est le nombre de liaisons covalentes qu'un atome peut former. Par conséquent, la covalence dépend du nombre d'électrons que l'atome peut partager avec d'autres atomes. L'état d'oxydation d'un atome est le nombre d'électrons gagnés ou perdus par un atome particulier lors de la formation d'une liaison chimique. Le différence clé entre la covalence et l'état d'oxydation est que le La covalence d'un atome est le nombre de liaisons covalentes que l'atome peut former alors que l'état d'oxydation d'un atome est le nombre d'électrons perdus ou gagnés par un atome lors de la formation d'une liaison chimique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la covalence
3. Qu'est-ce que l'état d'oxydation
4. Comparaison côte à côte - Covalence vs état d'oxydation sous forme tabulaire
5. Résumé
Qu'est-ce que la covalence?
La covalence est le nombre de liaisons covalentes qu'un atome peut former avec d'autres atomes. Par conséquent, la covalence est déterminée par le nombre d'électrons présents dans l'orbitale la plus externe d'un atome. Cependant, les termes valence et covalence ne doivent pas être confus car ils ont des significations différentes. La valence est la puissance combinée d'un atome. Parfois, la covalence est égale à la valence. Cependant, ça n'arrive pas toujours.
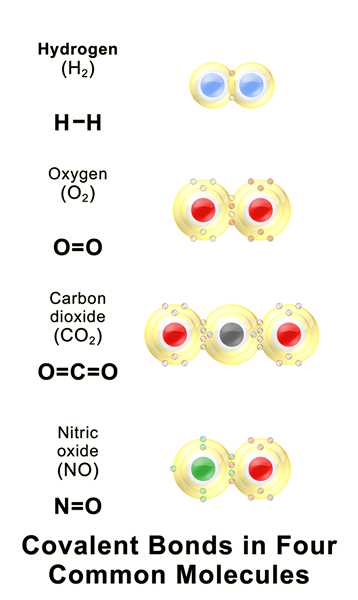
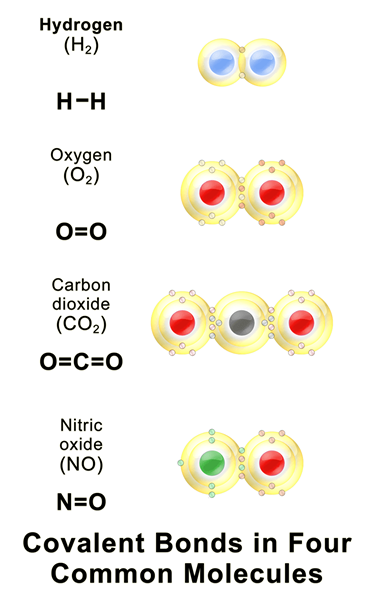
Figure 01: Quelques composés covalents courants
Une liaison covalente est une liaison chimique qui se forme lorsque deux atomes partagent leurs électrons non appariés les plus externes pour compléter la configuration d'électrons. Lorsqu'un atome a des coquilles d'électrons ou des orbitales incomplètes, cet atome devient plus réactif car les configurations d'électrons incomplètes sont instables. Par conséquent, ces atomes gagnent / lâche des électrons ou partagent des électrons afin de remplir les coquilles d'électrons. Le tableau suivant montre quelques exemples d'éléments chimiques avec différentes valeurs de covalence.
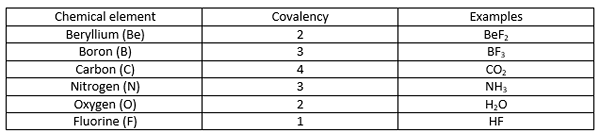
Qu'est-ce que l'état d'oxydation?
L'état d'oxydation d'un atome est le nombre d'électrons perdus, gagnés ou partagés par cet atome avec un autre atome. Si les électrons sont perdus ou gagnés, la charge électrique d'un atome est modifiée en conséquence. Les électrons sont des particules subatomiques chargées négativement dont la charge est neutralisée par la charge positive des protons en ce atome. Lorsque les électrons sont perdus, l'atome obtient une charge positive alors que lorsque les électrons sont gagnés, l'atome obtient une charge négative nette. Cela se produit en raison du déséquilibre des charges positives des protons dans le noyau. Cette charge peut être donnée comme l'état d'oxydation de cet atome.
L'état d'oxydation d'un atome est indiqué par un nombre entier avec le signe positif (+) ou négatif (-). Ce signe indique si l'atome a gagné ou perdu des électrons. Le nombre entier donne le nombre d'électrons qui ont été échangés entre les atomes.
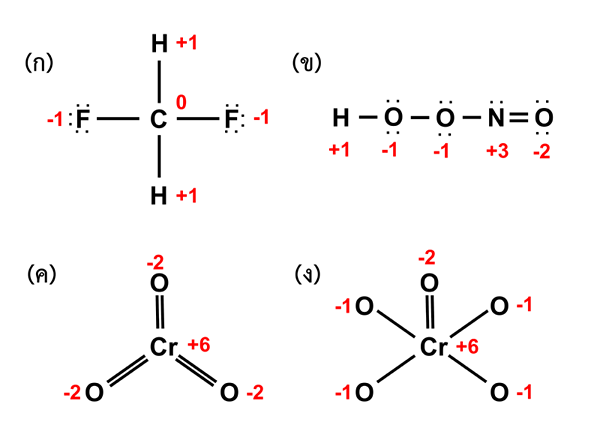
Figure 02: État d'oxydation de différents composés
Détermination de l'état d'oxydation d'un atome
L'état d'oxydation d'un atome particulier peut être déterminé en utilisant les règles suivantes.
- L'état d'oxydation d'un élément neutre est toujours nul. Ex: l'état d'oxydation du sodium (NA) est nul.
- La charge totale du composé doit être égale à la somme des charges de chaque atome présent dans ce composé. Ex: La charge totale de KCL est nul. Ensuite, les charges de K et Cl devraient être +1 et -1.
- L'état d'oxydation de l'élément du groupe 1 est toujours +1. Les éléments du groupe 1 sont le lithium, le sodium, le potassium, le rubidium, le césium et le francium.
- L'état d'oxydation des éléments du groupe 2 est toujours +2. Les éléments du groupe 2 sont le béryllium, le magnésium, le calcium, le strontium, le baryum et le radium.
- La charge négative est donnée à l'atome ayant une électronégativité plus élevée que celle des autres atomes liés à lui.
- L'état d'oxydation de l'hydrogène est toujours +1 sauf lorsque l'hydrogène est lié à un métal du groupe 1.
- L'état d'oxydation de l'oxygène est -2 sauf lorsqu'il se trouve sous forme de peroxyde ou de superoxyde.
Quelle est la différence entre la covalence et l'état d'oxydation?
Covalence vs état d'oxydation | |
| La covalence est le nombre de liaisons covalentes qu'un atome peut former avec d'autres atomes. | L'état d'oxydation d'un atome est le nombre d'électrons perdus, gagnés ou partagés par cet atome avec un autre atome. |
| Charge électrique | |
| La covalence n'indique pas la charge électrique d'un atome. | L'état d'oxydation donne la charge électrique d'un atome. |
| Une liaison chimique | |
| La covalence indique le nombre de liaisons chimiques (liaisons covalentes) qu'un atome particulier peut avoir. | L'état d'oxydation ne donne pas de détails sur les liaisons chimiques formées par un atome. |
| État de l'élément | |
| La covalence d'un élément pur dépend du nombre d'électrons présents dans la coque d'électrons la plus externe d'un atome de cet élément. | L'état d'oxydation d'un élément pur est toujours nul. |
Résumé - Covalence contre État d'oxydation
La covalence et l'état d'oxydation des atomes décrivent la nature chimique d'un atome dans un composé chimique. La différence entre la covalence et l'état d'oxydation est que la covalence d'un atome est le nombre de liaisons covalentes que l'atome peut former alors que l'état d'oxydation d'un atome est le nombre d'électrons perdus ou gagnés par un atome lors de la formation d'une liaison chimique.
Référence:
1.«Covalence.»Com, dictionnaire.com. Disponible ici
2."État d'oxydation.»Wikipedia, Wikimedia Foundation, 5 mars. 2018. Disponible ici
3.«Chimie-covalence et structures moléculaires."Com. Disponible ici
Image gracieuseté:
1.'Obligations covalentes' par Bruceblaus - propre travail, (CC BY-SA 4.0) via Commons Wikimedia
2.«Affectations d'état d'oxydation» par Saranphong Yimklan - Propre travaux, (domaine public) via Commons Wikimedia


