Différence entre la conjugaison et la résonance

Conjugaison vs résonance
La conjugaison et la résonance sont deux phénomènes importants pour comprendre le comportement des molécules.
Qu'est-ce que la conjugaison?
Dans une molécule, lorsqu'il y a des liaisons simples et multiples, nous disons que le système est conjugué. Par exemple, la molécule de benzène est un système conjugué. Dans un lien multiple, il y a une liaison sigma et un ou deux étangs Pi. Les obligations Pi sont composées en chevauchant les orbitales p. Les électrons dans les orbitales p sont situés perpendiculaires au plan de la molécule. Ainsi, quand il y a des liaisons Pi dans des liaisons alternées, tous les électrons sont délocalisés dans tout le système conjugué. En d'autres termes, nous l'appelons un nuage d'électrons. Étant donné que les électrons sont délocalisés, ils appartiennent à tous les atomes du système conjugué, mais pas pour un seul atome. Cela réduit l'énergie globale du système et augmente la stabilité. Non seulement, les liaisons Pi, mais aussi les paires d'électrons solitaires, les radicaux ou les ions carbénium peuvent participer à la création d'un système conjugué. Dans ces cas, il y a soit des orbitales P non collées avec deux électrons, un électron ou aucun électrons présent. Il existe des systèmes conjugués linéaires et cycliques. Certains sont limités à une seule molécule. Lorsqu'il existe des structures en polymère plus grandes, il peut y avoir de très grands systèmes conjugués. La présence de conjugaison permet aux molécules d'agir comme des chromophores. Les chromophores peuvent absorber la lumière; Par conséquent, le composé sera coloré.
Qu'est-ce que la résonance?
Lors de l'écriture de structures Lewis, nous ne montrons que des électrons de valence. En faisant part de la part des atomes ou en transférant des électrons, nous essayons de donner à chaque atome la configuration électronique de gaz noble. Cependant, dans cette tentative, nous pouvons imposer un emplacement artificiel aux électrons. En conséquence, plus d'une structure de Lewis équivalente peut être écrite pour de nombreuses molécules et ions. Les structures écrites en modifiant la position des électrons sont appelées structures de résonance. Ce sont des structures qui n'existent qu'en théorie. Les structures de résonance indiquent deux faits sur la structure.
• Aucune des structures de résonance ne sera la bonne représentation de la molécule réelle. Et aucun ne ressemblera complètement aux propriétés chimiques et physiques de la molécule réelle.
• La molécule réelle ou l'ion sera mieux représentée par un hybride de toutes les structures de résonance.
Les structures de résonance sont représentées avec la flèche ↔. Voici les structures de résonance de l'ion carbonate (CO32-).
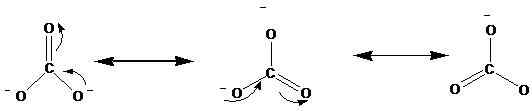
Des études sur les rayons X ont montré que la molécule réelle se situe entre ces résonances. Selon les études, toutes les liaisons en carbone-oxygène sont en longueur égale dans l'ion carbonate. Cependant, selon les structures ci-dessus, nous pouvons voir une double liaison et deux liaisons simples. Par conséquent, si ces structures de résonance se produisent séparément, idéalement, il devrait y avoir différentes longueurs de liaison dans l'ion. Les mêmes longueurs de liaison n'indiquent qu'aucune de ces structures réellement présente dans la nature, plutôt un hybride de cela n'existe.
| Quelle est la différence entre Conjugaison et résonance? • La résonance et la conjugaison sont interdépendantes. S'il y a une conjugaison dans une molécule, nous pouvons y dessiner des structures de résonance en alternant les liaisons PI. Étant donné que les électrons Pi sont délocalisés dans l'ensemble du système conjugué, toutes les structures de résonance sont valables pour une telle molécule. • La résonance permet à un système conjugué de délocaliser les électrons. |


